Chemia Analityczna I - tematy egzaminacyjne
28.01.2002. wariant I
Proszę obliczyć pH roztworów uzyskanych przez dodanie do 20,00 ml 0,2000 M roztworu kwasu mrówkowego (Ka = 1,80 x 10-4) :
- 5,00 ml wody (pH=2,27)
- 25,00 ml 0,1600 M roztworu NaOH (pH=7)
- 25,00 ml 0,2000 M roztworu NaOH (pH=11)
- 25,00 ml 0,2000 M roztworu mrówczanu sodu (pH=3,97)Na powierzchni roztworu manganianu (VII) potasu pozostawionego przez kilka godzin w biurecie pojawia się brunatny osad. Proszę napisać równanie reakcji tworzenia się tego osadu.
Proszę podać definicje pojęć:
- faza stacjonarna
- nośnik
- czas retencji
- stała podziałuProszę wyjaśnić różnice pomiędzy:
- zarodkowaniem i wzrostem kryształów
- buforem pH i buforem potencjału
- strącaniem, postrącaniem i współstrącaniem
- peptyzacją i koagulacją
0,4690 g mieszaniny SrCO3 i CaCO3 wyprażono i otrzymano 0,2990 g mieszaniny tlenków. Proszę obliczyć skład procentowy mieszaniny węglanów (MSr 87,6; MCa 40,1; MC 12,0; MO 16,0). Odp:58,85%SrCO3 i 41,15%CaCO3
1.
5,00ml wody,
25ml 0,16M roztworu NaOH ![]()
25,00ml 0,2M roztworu NaOH ![]()
pKw=14
25,00ml 0,2M roztworu mrówczanu sodu ![]()
2.
Na skutek reakcji KMnO4 z substancja organiczna, ktora mogla dostac sie z otoczenia ( np kurz) do kropli roztworu KMnO4 uległ redukcji do MnO2<brunatny osad>.
KMnO4 + red---> MnO2 + K+ + utl(red)
utl(red)- utleniona forma substancji dzialajacej jako reduktor.
3.
Faza stacjonarna - jest stabilnie usytuowana w kolumnie lub na powierzchni polarnej (bibuła, płytka szklana).
Nośnik - substancja strącająca się z roztworu w identycznych warunkach jak związek wydzielany i dodawany do roztworu w celu ilościowego strącania jego śladowych ilości.
Czas retencji - czas pomiędzy wstrzyknięciem próbki na czoło kolumny a zarejestrowaniem substancji prze detektor.
Stała podziału - opisuje stan równowagi reakcji A(wod)=A(org) P=[A]o/[A]w przy czym [A]o i [A]w oznaczają stężenia danego składnika w rozpuszczalniku organicznym i w roztworze wodnym. Prawo podziału jest słuszne, a stała podziału ma wartość niezmienną tylko wtedy gdy rozpuszczona substancja znajduje się w obydwu fazach w takiej samej postaci.
4.
Różnice pomiędzy:
Peptyzacja i koagulacja - peptyzacja jest to przemiana żelu w zol, natomiast koagulacja jest to przemiana zolu w żel.
Zarodkowanie i wzrost kryształów - zarodkowanie jest to proces w efekcie którego spotyka się minimalna liczba atomów, jonów lub cząsteczek tworząc stabilną mikro cząsteczkę ciała stałego przy przewodnim zarodkowaniu tworzy się wiele agregatów o małych rozmiarach przy mechanicznym wzroście kryształów - agregatów jest mniej lecz większych rozmiarów, zatem przy zarodkowaniu (Q-S) jest duże i powstaje osad koloidalny, przy wzroście kryształów (Q-S) jest małe i powstaje osad krystaliczny.
Buforem pH i buforem potencjału - roztwór słabego kwasu i słabej soli wykazuje niemal stałe pH nie zmieniające się przy rozcieńczaniu i dodaniu niewielkiej ilości mocnych kwasów lub zasad. Bufor potencjału utrzymuje stałą wartość potencjału nawet po dodaniu niewielkich ilości utleniacza lub reduktora, ale zmienia potencjał po rozcieńczeniu.
Strącanie, postrącanie i współ-strącanie - strącanie to wydzielanie z roztworu składników w postaci osadów; postrącanie polega na strącaniu się na powierzchni strąconego osadu, osadu innego jonu. Współstrącanie jest procesem polegającym na wytrącaniu wraz z osadem oznaczanego makroskładnika związków, które w danych warunkach są rozpuszczalne w roztworze. Współstrącają się te związki, których iloczyny rozpuszczalności nie są przekroczone wskutek ich małego stężenia lub dużej rozpuszczalności.
5.
SrCO3 SrO + CO2
CaCO3 CaO + CO2
mwęglanów = 0,469g
mtlenków = 0,299g
MSrCO3 = 147,6 g/mol ; MCaCO3 = 100,1 g/mol ; MCaO = 56,1 g/mol ; MSrO = 103,6 g/mol
nCaCO3 = x
nSrCO3 = y
tworzymy układ równań z dwiema niewiadomymi:
147,6g/mol * y + 100,1g/mol * x = 0,469g
103,6g/mol * y + 56,1g/mol * x = 0.299g
y = 2,886 * 10^-3 mol- 0,5415 * x
147,6g/mol*(2,886 *10^-3 mol - 0,5415 * x) + 100,1*x = 0,469g
y = 2,886 * 10^-3 mol- 0,5415 * x
0,4263g - 79,9254g/mol *x + 100,1g/mol *x = 0,469g
20,1746g/mol * x = 0,0427g
y = 2,886 * 10^-3 mol- 0,5415 * x
x = 2,1165 *10^-3 mol
y = 1,7399 *10^-3 mol
%SrCO3 = (y*MSrCO3)/ mwęglanów *100% = 54,76% %CaCO3 = 45,24%
28.01.2002. wariant II
Proszę obliczyć zmianę pH roztworów uzyskanych przez dziesięciokrotne rozcieńczenie wodą poniższych roztworów:
- woda (pH=7)
- 0,0500 M roztwór NaOH (pH=8,7)
- 0,0500 M roztwór kwasu octowego (Ka = 1,75 x 10-5) (pH=3,53)
- 0,0500 M roztwór kwasu octowego + 0,0500 M roztwór octanu sodu (pH=4,76)Zakwaszenie roztworu tiosiarczanu sodu za pomocą roztworu kwasu solnego powoduje pojawianie się białego osadu. Proszę napisać uzgodnione równanie reakcji opisującej obserwowane zjawisko.
Proszę podać definicje pojęć:
- faza ruchoma
- współczynnik podziału
- iloczyn rozpuszczalności
- współczynnik retencjiProszę wyjaśnić różnice pomiędzy:
- osadem krystalicznym i osadem koloidowym
- parą jonową i chelatem wewnętrznym
- okluzją i tworzeniem kryształów mieszanych
- specyficznym i selektywnym odczynnikiem strącającym
Z dwóch próbek o masach 0,2500 g zawierających 96% FeCl3 po rozpuszczeniu strącono osady AgCl lub FeCl3 · nH2O. Ile będą ważyły osady AgCl i Fe2O3 po wysuszeniu (wyprażeniu)? (MFe 55,9; MAg 107,9; MCl 35,5; MO 16,0)
- woda (pH=7)
W czystej wodzie stężenie jonów wodorowych [H+] i wodorotlenkowych [OH-] są sobie równe: [H+]= [OH-]= x
Kw=x2
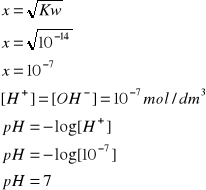
- 0,0500 M roztwór NaOH (pH=8,7)
-->
[Author:k]
Początkowe C=5*10-2M/10^3=5*10-5 --> [Author:k]
Po 10 krotnym rozcieńczeniu C=5*10-6
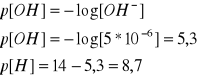
- 0,0500 M roztwór kwasu octowego (Ka = 1,75 x 10-5) (pH=3,53)
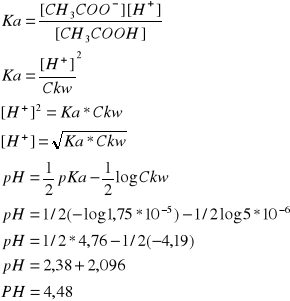
K= tak jak po lewej
K=Cz/Cnz = Cz/C0-Cz
Cz-stezenie zdysocjoiwanego
Cnz-stezenie niezdysocjoiwanego
Cz=[H+]
K=[H+]2/C0-[H+] i stad [H+], dalej pH
Po rozcieńczenie zmieniamy C0 na 10 razy mniejsze
- 0,0500 M roztwór kwasu octowego + 0,0500 M roztwór octanu sodu (pH=4,76)
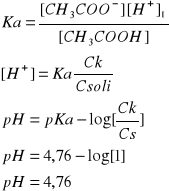
Zakwaszenie roztworu tiosiarczanu sodu za pomocą roztworu kwasu solnego powoduje pojawianie się białego osadu. Proszę napisać uzgodnione równanie reakcji opisującej obserwowane zjawisko.
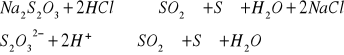
Proszę podać definicje --> pojęć[Author:k] :
- faza ruchoma
Faza ruchoma - jest to faza która niosąc substancje rozdzielane przesuwa się nad lub poprzez fazę stacjonarną.
- współczynnik podziału
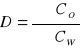
do ekstrakcji (wielkość uwzględniająca wpływ zachodzących reakcji chemicznych substancji w obu fazach, stanowi stosunek sumy stężeń wszystkich form substancji w fazie organicznej do sumy stężeń w fazie wodnej) lub do chromatografii ![]()
(stosunek stężenia substancji w fazie
- iloczyn rozpuszczalności
Iloczyn rozpuszczalności - jest to iloczyn stężenia tej substancji w roztworze pozostającym w równowadze z osadem.
- współczynnik retencji
Współczynnik retencji - jest to stosunek zredukowanego czasu retencji do martwego czasu retencji ; ![]()
; VS objętość fazy stacjonarnej, VR objętość fazy ruchomej, optymalne rozdzielenie zapewnia 5>k>1
Proszę wyjaśnić różnice pomiędzy:
- osadem krystalicznym i osadem koloidowym
Osad krystaliczny - o budowie krystalicznej, uporządkowanej, strąca się go z roztworów rozcieńczonych, po ogrzaniu roztworu dodaje się odczynnika strącajacego powoli i miesza; osad sączy się po pewnym czasie, wyróżnia się osady drobno- i grubo-krystaliczne.
Osad koloidalny - o budowie nieuporządkowanej zewnętrznie, cząsteczki trudno rozpuszczalnej substancji łączą się w zespoły (aglomeraty), są obdarzone jednoimiennym ładunkiem elektrycznym, które odpychając się wzajemnie tworzą zol, pod wpływem elektrolitu ładunki zostają zobojętnione i następuje koagulacja zolu, jeśli osad jest przemywany wodą może nastąpić peptyzacja; strąca się ze stężonych roztworów w obecności elektrolitów, sączy się bezpośrednio po strącaniu.
- parą jonową i chelatem wewnętrznym
Para jonowa - kompleksy asocjacyjne powstające z udziałem dwóch jonów (najczęściej kompleksowych) o przeciwnych ładunkach (na zasadzie oddziaływań elektrostatycznych).
Chelat wewnętrzny - obojętne pierścieniowe kompleksy powstające z udziałem ligandów, w których występują przynajmniej 2 atomy donorowe zdolne do utworzenia wiązań (ze względów sterycznych) z jonem centralnym
- okluzją i tworzeniem kryształów mieszanych
Okluzja - zanieczyszcza osad, rodzaj współ-strącania, w którym obce jony z warstwy podwójnej są zatrzymywane w trakcie szybkiego wzrostu kryształu; mechaniczne zatrzymywanie przez szybko rosnące kryształy.
Tworzenie kryształów mieszanych - rodzaj współ-strącania, w którym jon zanieczyszczający zastępuje jeden z jonów osadu w sieci krystalicznej (występować może gdy jon zastępujący i zastępowany mają taki sam ładunek a ich rozmiary nie różnią się nie więcej niż o 5%.
- specyficznym i selektywnym odczynnikiem strącającym
Specyficzny odczynnik strącający - odczynnik który w określonych warunkach reaguje tylko z jednym pierwiastkiem.
Selektywny odczynnik strącający - odczynnik który w optymalnych warunkach reaguje z niewielką ilością pierwiastków. Ten sam odczynnik strącający może być specyficzny, selektywny lub grupowy.
ZADANIE
Zakladam reakcje:
![]()
1 mol - 3 mole 0,25*96%=0,24g
162,4g- 430,2
0,24- x
X=0,66225g
x- 0,6623g
![]()
1mol- 1 mol
162,4g- 162,4+n18
0,24-x
![]()
Wydaje mi się, że nie będzie się strącał osad FeCl3, ale właśnie Fe2O3.
Tak więc:
n(Fe)=n(FeCl3)=(0.96*0.25)/162.3=1.4787 mmol
n(Fe2O3)=0.5*n(FeCl3)=0.73935 mmol
m(Fe2O3)=n(Fe2O3)*M(Fe2O3)=0.73935*10-3*159.6 =0.1180g
zakladając, że otrzymany Fe2O3 jest bezwodny
Dla stracania AgCl analogicznie:
n(Cl-)=3n(FeCl3)
n(AgCl)=n(Cl-)
m(AgCl)=n(AgCl)* M(AgCl)
Chemia Analityczna I - tematy egzaminacyjne
4.02.2003, wariant I
Dlaczego w miareczkowaniach redoksometrycznych w charakterze titrantów częściej stosuje się roztwory utleniaczy niż reduktorów?
Na powierzchni roztworu manganianu (VII) potasu pozostawionego przez kilka godzin w biurecie pojawia się brunatny osad. Proszę napisać równanie reakcji tworzenia się tego osadu.
Proszę podać definicje pojęć:
- faza stacjonarna
- nośnik
- czas retencji
- stała podziałuProszę wyjaśnić różnice pomiędzy:
- zarodkowaniem i wzrostem kryształów
- buforem pH i buforem potencjału
- strącaniem, postrącaniem i współstrącaniem
- peptyzacją i koagulacją
0,4690 g mieszaniny SrCO3 i CaCO3 wyprażono i otrzymano 0,2990 g mieszaniny tlenków. Proszę obliczyć skład procentowy mieszaniny węglanów (MSr 87,6; MCa 40,1; MC 12,0; MO 16,0).
1.
Ponieważ reduktory mogłyby się utlenić tlenem z powietrza co nie występuje w przypadku utleniaczy.(poza tym wydaje mi się że w przypadku miareczkowania utleniaczami np. KMnO4 łatwiejsze jest zarejestrowanie punktu końcowego niż w przypadku odwrotnym ale to tylko takie moje małe przemyślenia - przypisek mój)
2.
Na skutek reakcji KMnO4 z substancja organiczna, ktora mogla dostac sie z otoczenia ( np kurz) do kropli roztworu KMnO4 uległ redukcji do MnO2<brunatny osad>.
KMnO4 + red---> MnO2 + K+ + utl(red)
utl(red)- utleniona forma substancji dzialajacej jako reduktor.
Faza stacjonarna - jest stabilnie usytuowana w kolumnie lub na powieżchni polarnej (bibuła, płytka szklana).
Nośnik - substancja strącająca się z roztworu w identycznych warunkach jak związek wydzielany i dodawany do roztworu w celu ilościowego strącania jego śladowych ilości.
Czas retencji - czas pomiędzy wstrzyknięciem próbki na czoło kolumny a zarejestrowaniem substancji prze detektor.
Stała podziału - opisuje stan równowagi reakcji A(wod)=A(org) P=[A]o/[A]w przy czym [A]o i [A]w oznaczają stężenia danego składnika w rozpuszczalniku organicznym i w roztworze wodnym. Prawo podziału jest słuszne, a stała podziału ma wartość niezmienną tylko wtedy gdy rozpuszczona substancja znajduje się w obydwu fazach w takiej samej postaci.
4.
Różnice pomiędzy:
Peptyzacja i koagulacja - peptyzacja jest to przemiana żelu w zol, natomiast koagulacja jest to przemiana zolu w żel.
Zarodkowanie i wzrost kryształów - zarodkowanie jest to proces w efekcie którego spotyka się minimalna liczba atomów, jonów lub cząsteczek tworząc stabilną mikro cząsteczkę ciała stałego przy przewodnim zarodkowaniu tworzy się wiele agregatów o małych rozmiarach przy mechanicznym wzroście kryształów - agregatów jest mniej lecz większych rozmiarów, zatem przy zarodkowaniu (Q-S) jest duże i powstaje osad koloidalny, przy wzroście kryształów (Q-S) jest małe i powstaje osad krystaliczny.
Buforem pH i buforem potencjału - roztwór słabego kwasu i słabej soli wykazuje niemal stałe pH nie zmieniające się przy rozcieńczaniu i dodaniu niewielkiej ilości mocnych kwasów lub zasad. Bufor potencjału utrzymuje stałą wartość potencjału nawet po dodaniu niewielkich ilości utleniacza lub reduktora, ale zmienia potencjał po rozcieńczeniu.
Strącanie, postrącanie i współ-strącanie - strącanie to wydzielanie z roztworu składników w postaci osadów; postrącanie polega na strącaniu się na powierzchni strąconego osadu, osadu innego jonu. Współstrącanie jest procesem polegającym na wytrącaniu wraz z osadem oznaczanego makroskładnika związków, które w danych warunkach są rozpuszczalne w roztworze. Współstrącają się te związki, których iloczyny rozpuszczalności nie są przekroczone wskutek ich małego stężenia lub dużej rozpuszczalności.
5.
SrCO3 SrO + CO2
CaCO3 CaO + CO2
mwęglanów = 0,469g
mtlenków = 0,299g
MSrCO3 = 147,6 g/mol ; MCaCO3 = 100,1 g/mol ; MCaO = 56,1 g/mol ; MSrO = 103,6 g/mol
nCaCO3 = x
nSrCO3 = y
tworzymy układ równań z dwiema niewiadomymi:
147,6g/mol * y + 100,1g/mol * x = 0,469g
103,6g/mol * y + 56,1g/mol * x = 0.299g
y = 2,886 * 10^-3 mol- 0,5415 * x
147,6g/mol*(2,886 *10^-3 mol - 0,5415 * x) + 100,1*x = 0,469g
y = 2,886 * 10^-3 mol- 0,5415 * x
0,4263g - 79,9254g/mol *x + 100,1g/mol *x = 0,469g
20,1746g/mol * x = 0,0427g
y = 2,886 * 10^-3 mol- 0,5415 * x
x = 2,1165 *10^-3 mol
y = 1,7399 *10^-3 mol
%SrCO3 = (y*MSrCO3)/ mwęglanów *100% = 54,76% %CaCO3 = 45,24%
Chemia Analityczna I - tematy egzaminacyjne
4.02.2003, wariant II
Proszę wymienić i scharakteryzować układy ekstrakcyjne.
Zakwaszenie roztworu tiosiarczanu sodu za pomocą roztworu kwasu solnego powoduje pojawianie się białego osadu. Proszę napisanie uzgodnione równanie reakcji opisującej obserwowane zjawisko.
Proszę podać definicje pojęć:
- faza ruchoma
- współczynnik podziału
- iloczyn rozpuszczalności
- współczynnik retencjiProszę wyjaśnić różnice pomiędzy:
- kompleksem wielordzeniowym i kompleksem chelatowym
- ogniwem galwanicznym i ogniwem elektrolitycznym
- amfoterem kwasowo-zasadowym i amfoterem redoks (proszę podać przykłady)
- współczynnikiem retencji i współczynnikiem selektywności (w chromatografii)
Z dwóch próbek o masach 0,2500 g zawierających 96% FeCl3 po rozpuszczeniu strącono osady AgCl lub FeCl3 · nH2O. Ile będą ważyły osady AgCl i Fe2O3 po wysuszeniu (wyprażeniu)? (MFe 55,9; MAg 107,9; MCl 35,5; MO 16,0)
OPRACOWANIE TEGO EGZAMINU JESTW ZAŁĄCZONYM PDF
Chemia Analityczna I - tematy egzaminacyjne
11.02.2003, wariant I
Proszę omówić pojęcia:
- dyfuzja wirowa
- mianowanie roztworu titranta
- normalny i formalny potencjał elektrodyDlaczego roztwór jodu stosowany w jodometrycznych miareczkowaniach przygotowuje się przez rozpuszczenie I2 w stężonym roztworze jodku potasu?
Proszę dokończyć i uzgodnić równania redoks:
IO3- + I- →
Cu2+ + Fe2+ →
BrO3- + Sn2+→Proszę omówić rodzaje miareczkowań kompleksometrycznych.
Analizowano próbkę zanieczyszczonego chlorku baru o masie 0,5000 g. Po rozpuszczeniu próbki dodano 50,00 ml 0,1202 M roztworu azotanu srebra, którego nadmiar zmiareczkowano po odsączeniu osadu za pomocą 23,50 ml 0,1175 M roztworu rodanku amonu. Ile procent czystego BaCl2 zawierała próbka?
(MBa 137,3; MCl 35,5) Odp:67,37%
Zad1
Dyfuzja Wirowa - wynika z występowania wielu możliwych torów „strumienia” fazy ruchomej pomiędzy drobinami fazy stałej wypełniającej kolumnę i dyfuzji substancji pomiędzy tymi torami, a także dyfuzji do „martwych” - statycznych mikro-objętości fazy ruchomej immobilizowanych w porach wypełnienia.
Mianowanie roztworu titranta - dokładne ustalanie stężenia titranta z użyciem znanej ilości substancji podstawowej.
normalny potencjał elektrody - opisuje zawsze jej potencjał redukcyjny z definiowanego standardowego układu odniesienia o umownej wartości 0,00V (elektroda wodorowa); jest mierzony gdy aktywność wszystkich substratów i produktów obu reakcji połówkowych = 1,00; jest miarą siły napędowej reakcji połówkowej od stanu, w którym stężenia substratów są jednostkowe do stanu w którym osiągane są stężęnia równowagowe;
formalny(rzeczywisty) potencjał redox - określa potencjał normalny układu w danych warunkach roztworu (pH i czynniki kompleksujące). Na podstawie tych potencjałów można przewidywać przebieg sprzężonych reakcji redox. Potencjał formalny jest rzeczywistym potencjałem elektrody jeśli:
analityczne stężenia wszystkich substratów są jednostkowe
znajdujące się w roztworze wszystkie inne substancje mogące wpływać na wartość potencjału, występują w znanych stężeniach
jest on mierzony względem NEW;
zad2
Ponieważ jod atomowy ( I2) po rozpuszczeniu w czystej wodzie jest dość lotny i może to prowadzić do błędów w oznaczeniach. Po dodaniu anionów jodkowych zachodzi reakcja:
I2 + I- ↔ I3-
Powstaje nielotny anion trójjodkowy. Dodaje się nadmiar KI aby równowagę reakcji przesunąć w prawo i otrzymać jak najwięcej nielotnej formy jodu.
Zad3
IO3- + 5I- → 3I2 + 3O2- / IO3- + 5I- + 6H+→ 3I2 + 3H2O
Cu2+ + Fe2+ →Cu+ + Fe3+
BrO3- + 3Sn2+→ Br- + 3Sn4+ + 3O2- / BrO3- + 3Sn2+ + 6H+→ Br- + 3Sn4+ + 3H2O
Zad4
Miareczkowanie proste/bezpośrednie - oznaczana substancja reaguje z titrantem szybko i łatwe jest określenie PK. Miareczkowanie polega na bezpośrednim dodawaniu titranta do próbki aż do zaobserwowania PK. np. miareczkowe oznaczanie Mg2+ za pomocą EDTA.
Miareczkowanie odwrotne - jeśli odczynnik, którym się miareczkuje, reaguje z oznaczaną substancją powoli lub osiągnięcie PR wymaga nadmiaru titranta. Do badanego roztworu dodaje się nadmiar titranta, czeka się aż reakcja zajdzie do końca. Następnie odmiareczkowuje się nadmiar titranta odpowiednim pomocniczym mianowanym roztworem., reagującym szybko i stechiometrycznie z titrantem wobec odpowiedniego wskaźnika. np. Miareczkowe oznaczanie Al3+ za pomocą nadmiaru EDTA i mianowanego roztworu Zn2+.
Miareczkowanie pośrednie - oznaczana substancja nie reaguje z titrantem lub niemożliwe jest ustalenie PK miareczkowania. Metoda polega na dodaniu trzeciej substancji, która reagując stechiometrycznie i ilościowo z oznaczaną substancją tworzy nowy związek, reagujący szybko i stechiometrycznie z titrantem. Np. Miareczkowe oznaczanie Ca2+ za pomocą EDTA przy wcześniejszemu dodaniu kompleksu EDTA z Mg i z czernią eriochromową T jako wskaźnikiem.
Zad5
MBaCl2 = 137,3+2*35.5 = 208,3 g/mol nBaCl2 = nBa2+ = x
nAgNO3 = 50cm3 * 0,1202 mmol/cm3 = 6,01 mmol nNH4SCN= 23,5cm3 * 0,1175mmol/cm3 = 2,761 mmol
BaCl2 + 2AgNO3 → BaNO3 + 2AgCl↓ AgCl + NH4SCN → NH4Cl + AgSCN↓
6,01- 2x - 2,761 = 0 (bo zmiareczkowano cały AgNO3; część poszła na bar, reszta na NH4SCN)
X = 1,625 mmol = 1,625 * 10-3 mol
mBaCl2 = nBaCl2 * MBaCl2 = 1,625 * 10-3 mol * 208,3 g/mol = 0,3385 g
%BaCl2 = 0,3385/0,5 *100% = 67,7%
Chemia Analityczna I - tematy egzaminacyjne
11.02.2003, wariant II
Proszę omówić pojęcia:
- dyfuzja podłużna
- klucz elektrolityczny
- nadnapięcie stężenioweDlaczego podczas działania elektrody wodorowej przemywa się elektrodę platynową strumieniem wodoru?
Proszę dokończyć i uzgodnić równania redoks:
MnO4- + SO2 →
HNO2 + MnO4- →
UO22+ + Zn(s) →Rodzaje miareczkowań redoksometrycznych.
brak zadania
Proszę omówić pojęcia:
- dyfuzja podłużna - dyfuzja liniowa wzdłuż osi kolumny, poszerza pasmo docierające do detektora, na skutek migracji dyfuzyjnej cząstek od punktu o największym stężeniu substancji rozdzielanej, do jego czoła i części kończącej
- klucz elektrolityczny- rurka zakończona spiekami szklanymi wypełnionymi roztworem elektrolitu umożliwiająca przepływ ładunku i uniemożliwiająca przepływ masy pomiędzy roztworami
- nadnapięcie stężeniowe( analiza wagowa metody elektrograwimetryczne)
Jony ulegające reakcjom elektrodowym wędrują do warstwy przyelektrodowej dzięki:
*migracji-warunkowanej elektrostatycznym przyciąganiem jonów przez naładowane powierzchnie elektrod. Efekt migracyjny nasila się ze wzrostem napięcia
*konwekcji- warunkowanej czynnikami mechanicznymi(mieszanie), a także temperaturą, gęstością roztworu itp.
Dlaczego podczas działania elektrody wodorowej przemywa się elektrodę platynową strumieniem wodoru?
Platyna nie bierze bezpośredniego udziału w reakcji elektrodowej, a pokryta czernią platynową obmywana nasyconym wodorem zachowuje się jakby była elektrodą wodorową zbudowaną z samego wodoru
H2=2H++2e
Rodzaje miareczkowań redoksometrycznych:
Metodami redoksometrycznymi nazywamy łącznie metody oksydymetryczne i metody reduktometryczne. Zwykle przed miareczkowaniem erdoks trzeba przeprowadzić oznaczaną postać w postać zredukowaną( jeżeli mamy działać roztworem utleniacza) lub w postać utlenioną ( jeśli mamy miareczkować roztworem reduktora). Stosuje się najczęściej takie reduktory i utleniacze, które następnie łatwo można usunąć z roztworu.
W metodach oksydymetrycznych miareczkuje się odczynnikiem o właściwościach utleniających, zaś w reduktometrycznych redukującym.
Metody osydymetryczne służą do bezpośredniego oznaczania substancji o charakterze redukującym, do tych metod zaliczamy manganometrie, chromianometrie, bromianometrie i cerometrie.
Medoty reduktometryczne miareczkuje się odczynnikiem redukującym do oznaczania substancji o właściwościach utleniających np.tytanometria, jodometria
( mianowanym roztworem tiosiarczanu sodowego odmiareczkowuje się jod, wydzielany w równoważnej ilości w reakcji między oznaczaną substancją utleniającą a jodem)
Chemia Analityczna I - tematy egzaminacyjne
27.06.2003, wariant I
Proszę podać definicje pojęć:
- miareczkowanie odwrotne
- iloczyn rozpuszczalności
- współczynnik retencjiDlaczego typowe wskaźniki kwasowo-zasadowe zmieniają swe zabarwienie w zakresie pH obejmującym 2 jednostki?
Proszę dokończyć i uzgodnić równania redoks:
I- + Ag(s) + Sn4+ →
ClO3- + Fe2+ →
MnO4- + C2O42- →Proszę scharakteryzować rodzaje oznaczeń wagowych.
Wodorotlenek sodu zawiera 5% węglanu sodu. Jaka objętość kwasu solnego zostanie zużyta na zmiareczkowanie jego próbki wobec oranżu metylowego, jeżeli na zmiareczkowanie takiej samej próbki wobec fenoloftaleiny zużyto 38,75 ml tego kwasu.
Proszę podać definicje pojęć:
Miareczkowanie odwrotne - gdy kompleksy są trwałe ale tworzą się powoli, do roztworu dodawany
jest nadmiar odczynnika, który jest miareczkowany po odpowiednim czasie, za pomocą roztworu
EDTA, tworzącego labilny kompleks z EDTA.
iloczyn rozpuszczal.- stała termodynamiczna opisująca równowagę reakcji,
będącej podstawą miareczkowej metody strąceniowej lub metody wagowej;
Ka jest wyrażony iloczynem steżeń (w odpowiedniej potendze) jonów pozostających
w równowadze z osadem.
Współczynnik retencji - jest to stosunek zredukowanego czasu retencji do martwego
czasu retencji ; ![]()
;
VS objętość fazy stacjonarnej,
VR objętość fazy ruchomej,
optymalne rozdzielenie zapewnia 5>k>1
Proszę dokończyć i uzgodnić równania redoks:
I- + Ag(s) + Sn4+ Ⴎ nie zachodzi(?)
ClO3- + Fe2+ Ⴎ C1O3- + 6Fe2+ + 6H+ = Cl- +6Fe3+ + 3H2O
2MnO4- +5H2C2O42- +6H+ Ⴎ2Mn2++10CO2+8 H2O
Proszę scharakteryzować rodzaje oznaczeń wagowych.
Proszę scharakteryzować rodzaje oznaczeń wagowych.
Strącanie - strącanie osadu, starzenie lub koagulacja osadu, sączenie osadu, przemywanie osadu, doprowadzenie osadu do stałej masy poprzez suszenie lub prażenie, obliczenie wyniku.
Lotność - oparte na rozkładzie analizowanej substancji, z wydzieleniem lotnych produktów. Bezpośrednie pomiary masy uwolnionej wody, dwutlenku węgla. Pośrednie pomiary straty masy po ulotnieniu części badanej próbki.
Elektrograwimetryczne - polegają na wydzieleniu oznaczanego składnika w postaci metalu na katodzie i obliczenia przyrostu masy katody.
Chemia Analityczna I - tematy egzaminacyjne
27.06.2003, wariant II
Proszę podać definicje pojęć:
- kompleks chelatowy
- ligand
- warunkowa stała trwałości kompleksuProszę wyjaśnić różnice pomiędzy:
- osadem krystalicznym i osadem koloidowym
- parą jonową i chelatem wewnętrznym
- okluzją i tworzeniem kryształów mieszanych
- specyficznym i selektywnym odczynnikiem strącającymProszę dokończyć i uzgodnić równania redoks:
NO3- + Cu(s) →
H2O2 + Ce4+ →
Ag(s) + I- →Proszę omówić zjawiska wpływające na poszerzenie pasm chromatograficznych.
brak zadania
Chemia Analityczna I - egzamin z 2006 roku.
1. Zasady doboru wskaźników
a) alkacymetrycznych
b) kompleksometrycznych
2. czym się myje osady
a) krystaliczne
b) koloidalne
3. Detektory w chromatografii cieczowej
4. Faza stacjonarna w chromatografii cieczowej
5. Mechanizmy strącania z nośnikami organicznymi
6. Mechanizm reakcji żelaza (III) w środowisku HCl z eterem alkoholu izoamylowego.
Brak zadania
zerówka
strącanie z r-ru homogenicznego, układy przy rodzielaniu, nadnapięcie kinetyczne, titranty stosowne w analizie miareczkowej i banalne zadanie rachunkowe.
Nadnapięcie kinetyczne wyjaśnić co to jest i czynniki wpływające.
2. Wymienić titranty stosowane w analizie miareczkowej.
3. Na czym polega strącanie z układów homogenicznych i przykłady.
4. Jeszcze coś było ale mi sie zapomniało.
Zadanie obliczeniowe proste.A wiem, jeszcze było wymienić układy ekstrakcyjne.
Drugi termin 2011
A
Metody wyznaczania punktu końcowego w miareczkowaniu redoksometrycznym. Zasada działania wskaźników redoksometrycznych.
Mechanizm powstawania osadów koloidalnych.
jakie osady będziemy ważyć przy miareczkowaniu argentometrycznym, jeśli jako titrant weźmiemy wodorotlenek, siarkowodór(???)
Narysować krzywą miareczkowania amoniaku za pomocą kwasu solnego i zaznaczyć jakie jony są odpowiedzialne za charakterystyczne punkty na krzywej (???)
Zadanie
Czysta mieszanina KCl i KSCN ważyła 0,3460g. Rozpuszczono ja a następnie jony Cl- i SCN- miareczkowano AgNO3, którego zużyto 40,30mL o stężeniu 0,1000M. Obliczyć jaki procenty mieszaniny stanowił KSCN. (???)
B
Sposoby miareczkowani kompleksometrycznych. Opisać metalowskaźniki.
Dlaczego KMnO4 nie miareczkujemy roztworem zawierającym jony Cl-.
Mechanizm strącania osadów krystalicznych.
Narysować krzywą miareczkowania kwasu octowego zasadą sodową i zaznaczyć punkty tak jak wyżej.
NO3- + Cu(s) -> może iść chyba na dwa sposoby, w zależności od stężenia, miedź idzie Cu(II), a jony azotanowe (V) do tlenku azotu (II) albo tlenku azotu (IV), reakcja powinna iść raczej w środowisku kwaśnym
H2O2 + Ce4+ -> wydzieli się tlen, a cer zredukuje się do Ce(III)
Ag(s) + I- -> (nie mam zbytnio pomysłu jak to mogłoby zajść)
I- + Ag(s) + Sn4+ -> (nie mam zbytnio pomysłu jak to mogłoby zajść)
ClO3- + Fe2+ -> wydaje mi się że żelazo pójdzie chyba do Fe(III), a chlorany (V) zredukuja sie do chlorków (środowisko chyba kwaśne powinno być)
MnO4- + C2O42- -> to jest łatwe: w kwaśnym środowisku manganiany (VII) zredukują sie do Mn(II), a szczawiany utlenią sie do dwutlenku węgla
MnO4- + SO2 -> wydaje mi się że manganiany (VII) zredukują się do Mn(II), siarka przejdzie na +VI stopień utlenienie jako siarczan (VI)
HNO2 + MnO4- -> w kwaśnym środowisku manganiany (VII) zredukują sie do Mn(II), a azotyny (azotany (III)) utlenią sie do azotanów (V)
UO22+ + Zn(s) -> jeśli takie coś by poszło to jony uranylowe powinny iść bodajże do uranu (IV) (z tego co pamiętam istnieje kation U(4+)), a cynk metaliczny powinien utlenić sie do Zn(II)
IO3- + I- -> to jest łatwa, typowa rekacja: zachodzi tylko w odpowiednio kwasowym środowisku, aniony jodkowe i jodanowe (V) ulegaja synproporcjonacji do wolnego jodu (I2)
Cu2+ + Fe2+ -> nie wiem czy to zajdzie, należałoby spojrzeć na wartości potencjałów, żelazo pójdzie raczej do Fe(III), nie jestem pewien co do miedzi - albo pójdzie do Cu(I) albo do miedzi metalicznej
BrO3- + Sn2+® -> bromiany (V) powinny iść do bromków, cyna do Sn(IV), środowisko chyyyba kwaśne
13
Początkowo pOH=-logC=-log(0.05)= 1.3
Więc pH=14-pOH=12.7
Dlaczego?!
Po rozcieńczeniu C=0.1*C0=0,005, pH=11,7
Jest OK
Nie sprawdzałem, ale pewnie robione na bazie wykładów, wiec OK
Wyszukiwarka
Podobne podstrony:
Redoksometria, Technologia chemiczna pw, 2 rok, anality
Analiza straceniowa, Technologia chemiczna pw, 2 rok, anality
Analiza wagowa, Technologia chemiczna pw, 2 rok, anality
Kompleksometria, Technologia chemiczna pw, 2 rok, anality
skrot pojec, Technologia chemiczna pw, 2 rok, anality
Redoksometria, Technologia chemiczna pw, 2 rok, anality
Biotechn3rnew, Technologia chemiczna pw, 2 rok, stata
30 Egzamin ECW 2006-01-30, Technologia chemiczna pw, 2 rok, stata
31 Egzamin ECW 2006-02-06, Technologia chemiczna pw, 2 rok, stata
co gdzie jest, Technologia chemiczna pw, 2 rok, infa
kol2, Technologia chemiczna pw, 2 rok, infa
kolos1, Technologia chemiczna pw, 2 rok, infa
Biotechn3rnew, Technologia chemiczna pw, 2 rok, stata
Biotechn3rnew, Technologia chemiczna pw, 2 rok, stata
Biotechn3rnew, Technologia chemiczna pw, 2 rok, stata
Biotechn3rnew, Technologia chemiczna pw, 2 rok, stata
więcej podobnych podstron