Rola fosforanu pirydoksalu PLP- koenzymu aminotransferaz w procesach biochemicznych i jego występowanie w produktach naturalnych (witamina B6)
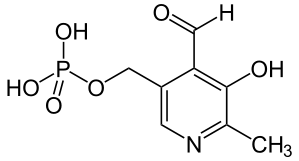
Fosforan pirydoksalu (PLP, pochodna witaminy B6) jest grupą prostetyczną wielu enzymów katalizujących procesy transformacji aminokwasów (aminotransferazy, syntazy, karboksylazy, racemazy) zarówno w bakteriach jak i w organizmach wyższych.
W ostatnich latach enzymy zależne od fosforanu pirydoksalu wzbudziły zainteresowanie biotechnologów, ponieważ znajdują one zastosowanie przede wszystkim w biosyntezie aminokwasów i ich pochodnych, w produkcji różnego rodzaju farmaceutyków oraz w ochronie środowiska. Naukowców ciekawi także to, że pomimo podobnej struktury enzymy zależne od PLP katalizują reakcję o różnym mechanizmie i należą od różnych klas enzymów. Ustalenie pokrewieństwa pomiędzy tymi białkami pozwoliło by zrozumieć ich ewolucję oraz lepiej poznać szlaki metaboliczne z ich udziałem. Enzymy PLP-zależne uczestniczą w procesach życiowych komórek roślin, zwierząt i mikroorganizmów. Biorą one bezpośredni udział w metabolizmie aminokwasów i ich pochodnych, a także uczestniczą w szlakach przemian aminocukrów oraz innych metabolitów zawierających grupę aminową. Selektywne zahamowanie aktywności niektórych enzymów PLP-zależnych u mikroorganizmów pozwoliłoby na skuteczniejszą walkę z patogenami. W związku z tym enzymy te stanowią coraz częściej cząsteczki docelowe dla farmaceutyków. Mutacje i defekty w strukturze enzymów PLP-zależnych mogą powodować poważne zakłócenia szlaków metabolicznych i choroby warunkowane genetycznie.
Fosforan pirydoksalu posiada dwie cechy, dzięki którym może katalizować szereg reakcji związanych z metabolizmem aminokwasów: za pośrednictwem swojej grupy aldehydowej może tworzyć wiązanie kowalencyjne z aminokwasami oraz, jako związek silnie elektrofilowy (dzięki obecności atomu azotu w pierścieniu aromatycznym), posiada zdolność przyciągania elektronów stabilizując w ten sposób ujemnie naładowane produkty pośrednie powstające podczas katalizy.
Enzymy zależne od fosforanu pirydoksalu, katalizują szereg różnych reakcji, takich jak: przekształcenie łańcucha bocznego przy zachowaniu ugrupowania α-aminokwasowego, dekarboksylacja i transaminacja do α-ketokwasów. Z teoretycznego punktu widzenia reakcje te polegają na przegrupowaniach elektronów w cząsteczce zasady Schiffa, która jest wspólnym produktem pośrednim tych procesów. Grupa aldehydowa PLP tworzy zasadę Schiffa z grupą ε aminową lizyny znajdującej się w centrum katalitycznym enzymy pod nieobecność substratu. Atom azotu w pierścieniu pirydynowym ma ładunek dodatni i dlatego powoduje przegrupowanie elektronów w cząsteczce. Wynikiem tego jest stan mezomerii, który jednakże może nastąpić tylko wtedy, gdy któryś z podstawników przy atomie węgla w pozycji α aminokwasu zostaje odłączony jako kation. Tym podstawnikiem może być reszta aminokwasowa R lub grupa karboksylowa (dekarboksylacja). Przejściowy stan materii ulega stabilizacji przez addycję protonu do atomu węgla α i następnie hydrolizę zasady Schiffa do aminy pierwszorzędowej. Podstawnikiem tym może być także (i jest w większości przypadków) atom wodoru przy atomie węgla w pozycji α.
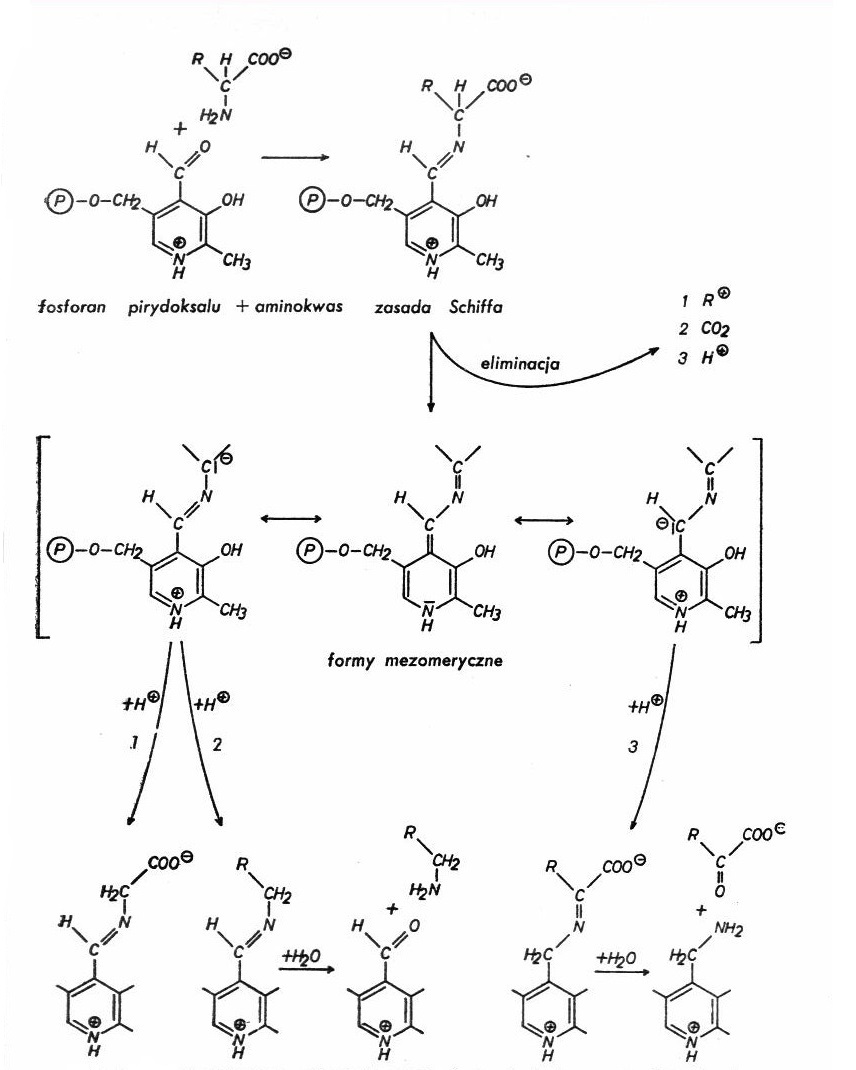
Odłączenie protonu stabilizuje podwójne wiązanie przy atomie węgla w pozycji α, a powstały produkt przejściowy rozpada się hydrolitycznie na fosforan pirydoksaminy i α-ketokwas. Jest to reakcja polegająca na przeniesieniu grupy aminowej na koenzym, przy jednoczesnej zmianie stopnia utlenienia węgla α cząsteczki aminokwasu (zmiana pojedynczego wiązania na podwójne w aminokwasie i podwójnego na pojedyncze w cząsteczce koenzymu).
Jedną z reakcji katalizowanych przez enzymy zależne od fosforanu pirydoksalu, wspomnianą przeze mnie jest transaminacja. Jest to reakcja, w której może uczestniczyć wiele naturalnych aminokwasów i ma ogromne znaczenie w przemianie materii, ponieważ pozwala organizmowi oszczędnie gospodarować azotem i wytwarzać aminokwasy z odpowiadających im szkieletów węglowych. Transaminacja jest katalizowana przez enzymy zwane transaminazami (aminotransferazami) i polega na przeniesieniu grupy aminowej z aminokwasu na szkielet węglowy, występujący w formie α-ketokwasu, zgodnie z reakcją:

Badacze Braunstein i Kritzman, jako pierwsi wykazali duże znaczenie transaminacji uzyskując w homogenatach tkanek zwierzęcych przeniesienie grupy aminowej z szeregu aminokwasów na α- etoglutaran, w wyniku czego tworzył się glutaminian. Później wykazano w tej przemianie udział fosforanu pirydoksalu jako koenzymu. W 1953r. Snell przeprowadził reakcję analogiczną przeniesienia grup NH2 z alaniny, asparaginianu i glutaminianu na kwas glioksylowy w obecności fosforanu pirydoksalu. Aminokwas wchodzi z związanym z enzymem fosforanem pirydoksalu w połączenie typu zasady Schiffa, po czym następuje przegrupowanie utworzonego wiązanie podwójnego, a następnie jego rozerwanie. W wyniku takich przemian wydziela się pozbawiony grupy aminowej α-ketokwas oraz fosforan pirydoksaminy, który z innym α-ketokwasem wchodzi w analogiczną, lecz w odwrotnym kierunku przebiegającą reakcję. Po przejściu przez stadium zasady Schiffa wydziela się wolny aminokwas i regeneruje fosforan pirydoksalu. Wszystkie stadia reakcji są odwracalne, a co za tym idzie cała reakcja jest w pełni odwracalna. Fosforan pirydoksalu o jego pochodne w trakcie reakcji są stale połączone z katalizującą te reakcję aminotransferazą.
Inną reakcją katalizowaną przez enzymy zależne od fosforanu pirydoksalu jest dekarboksylacja aminokwasów. Polega ona na rozerwaniu wiązania między grupą karboksylową i resztą cząsteczki, w wyniku czego wydziela się CO2 i powstaje amina. Enzymy katalizujące odłączenie grupy karboksylowej od aminokwasów, zwane dekarboksylazami aminokwasowymi, są rozpowszechnione zwłaszcza wśród bakterii, choć są również spotykane w innych organizmach. Enzymy te nie występują stale w komórkach bakterii, ale są wytwarzane w przypadku, gdy organizmy te bytują na pożywce bogatej w odpowiedni aminokwas, a więc ich synteza ma charakter procesu indukowanego przez obecność substratu w podłożu. Specyficzność dekarboksylaz w stosunku do określonego aminokwasu jako substratu jest bardzo duża. Dzięki niej oczyszczone preparaty dekarboksylaz są stosowane do manometrycznego oznaczania zawartości poszczególnych aminokwasów w ich mieszaninie na zasadzie wydzielanego CO2. Dekarboksylazy aminokwasowe, podobnie jak aminotransferazy, wymagają współdziałania fosforanu pirydoksalu, z którym aminokwasy wchodzą w połączenie typu zasady Schiffa. Dekarboksylacja aminokwasów prowadzi do wytworzenia tzw. biogennych amin, czyli związków o dużej aktywności fizjologicznej. W wyniku tej przemiany, obok ważnych biochemicznie produktów pośrednich w syntezie szeregu hormonów i innych związków czynnych powstają również substancji o własnościach toksycznych , charakterystyczne dla procesów gnicia. Do amin o charakterze hormonów lub produktów przejściowych przy ich powstawaniu należy mp. Histamina, która jest produktem dekarboksylacji histydyny, stymulująca wydzielanie soków trawiennych.
Witamina B6 znajduje się w wielu produktach żywnościowych. Najwięcej jest jej w mięsie, rybach, drobiu, jajkach, mleku i drożdżach. Dobrym źródłem tej witaminy są warzywa, takie jak kapusta, groszek zielony, kalafiory, marchew, szpinak, ziemniaki. Występuje w dużej ilości w zbożach (szczególnie kiełkach pszenicy), ziarnach soi, fasoli, orzeszkach ziemnych.
Bibliografia:
Kączkowski Jerzy, „Podstawy biochemii”, WNT Warszawa 1995
Bereta J. A. Koj, „Zarys biochemii”, Wyd E.J.B. 2009
Michał Woźniak, Maria Koziołkiewicz, „Enzymy zależne od fosforanu pirydoksalu - charakterystyka i zastosowanie w biotechnologii”, praca przeglądowa Wydział Biotechnologii i Nauk o Żywności, Instytut Biochemii Technicznej, Politechnika Łódzka, Łódź 2005
Magdalena Ryba, grupa 11B1, WIiTCh Politechnika Krakowska
Wyszukiwarka
Podobne podstrony:
Filozofia- moje notatki, WIiTCh PK Biotechnologia, semestr 2, Filozofia (Jacek Jaśtal)
Enzymy zalezne od fosforanu pirydoksalu charakterystyka i zastosowanie w biotechnologii
prezentacja rola fosforanu pirydoksalu
zagadnienia lab fiz, WIiTCh PK, Technologia Chemiczna, semestr 3, Chemia Fizyczna, laboratorium
sss teoria, Biotech, BIOTECHNOLOGIA, Semestr V, Spec. Bioinf, SSS, Egzamin
Atmosfera, Biotechnologia, Semestr I, Ochrona Środowiska
cw1 Zadania, Biotech, BIOTECHNOLOGIA, Semestr V, Spec. Bioinf, SSS, LAB, Lab 2
rola handlu zagranicznego w gospodarce kraju, makroekonomia semestr IV, międzynarodowe stosunki gosp
opracowanie skanow, Biotechnologia, Semestr III, Biologia molekularna
Program kursu ch.og.-cw wer. II, Biotechnologia, SEMESTR 1, Chemia ogólna
pytania na zaliczenie-zagrożenia ekologiczne, Studia, Technologia Chemiczna, I stopień, PK, II semes
Egzamin2007, Biotechnologia, Semestr III, Biochemia
14.10, Studia Biotechnologia, Semestr 7 - II stopnia - mikrobiologia molekularna, Metagenomika
Pytania z PCR 2, Studia Biotechnologia, Semestr 7 - II stopnia - mikrobiologia molekularna, Metody P
Rozdział mieszanin i roztworów, Biotechnologia, Semestr 1, Chemia ogólna, Egzamin
Zadania na 2 kolokwium z algebry, Biotechnologia, SEMESTR 1, Algebra liniowa z geometrią analityczną
Związki organiczne ChOgol, Biotechnologia, Semestr 1, Chemia ogólna, Egzamin
fosfor, Studia, I rok, I rok, II semestr, Gleboznawstwo
więcej podobnych podstron