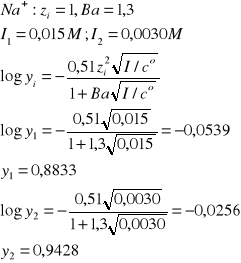
Zadania do tematu 1
Obliczanie pH i pOH w roztworach mocnych kwasów i zasad. Iloczyn jonowy wody. Siła jonowa, aktywność i współczynnik aktywności. Stała i stopień dysocjacji elektrolitycznej.
1,2,3,5,8/130; 10,11,13,14,16/131;17,18,19,20,21,22/132
5/131
V1 = 100 cm3, c1 = 0,015 M NaCl, I1 = ?, a1(Na+) = ?
VH2O = 400 cm3
V2 = V1 + VH2O = 500 cm3, c2 = V1c1/V2 = 0,015/5 = 0,0030 M NaCl, I2 = ?, a2(Na+) = ?
ai = yici
[Na+]1 = 0,015 M, I1 = 0,015 M
[Na+]2 = 0,0030 M, I = 0,0030 M
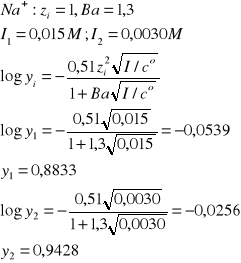
![]()
8*/131
I = 1B, pKw = 13,73 w T = 298 K
pKw = pcH + pcOH; [H+] = 10-pcH ·co
pcOH = 2,93, pcH = 13,73 - 2,93 = 10,80;
[H+] = 1.6·10-11 mol/dm3
pcOH = 5,18, pcH = 13,73 - 5,18 = 8,55;
[H+] = 2,8·10-9 mol/dm3
pcOH = 8,63, pcH = 13,73 - 8,63 = 5,10;
[H+] = 7,9·10-6 mol/dm3
pcOH = 12,85, pcH = 13,73 - 12,85 = 0,88;
[H+] = 1,3·10-1 mol/dm3
10/131
Zmieszano roztwory NaOH i NaCl. W uzyskanym roztworze mamy dwa elektrolity mocne:
NaOH→Na+ + OH- (1)
NaCl→ Na+ + Cl- (2)
W roztworze tym stężenie jonów Na+ jest sumą stężeń obydwu elektrolitów, a stężenie jonów Cl- jest równe stężeniu NaCl:
[Na+] = cNaOH + cNaCl; [Cl-] = cNaCl
Obliczyć pcH tego roztworu, jeśli I = 2D oraz pcNa = 2,15; pcCl = 2,75
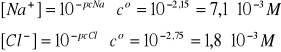
}Obliczone stężenia - dwie cyfry znaczące!
cNaOH = [Na+] - cNaCl = 7,1∙10-3 - 1,8∙10-3 = 5,3∙10-3 mol/dm3
[OH-] = cNaOH = 5,3∙10-3 mol/dm3
pcOH = 2,28
pKw = 13,88, pcH = pKw - pcOH = 13,88 - 2,88 = 11,60
13/131
Zmieszano
V1 = 275 cm3 HNO3, c1 = 0,050 mol/dm3
V2 = 325 cm3 HCl, c2 = 0,010 mol/dm3
Uzyskany roztwór zawiera dwa mocne kwasy jednozasadowe typu HX. Obliczamy sumę ich liczności:
![]()
Obydwa kwasy reagują z dodanym KOH:
HX + KOH = KX + H2O
mKOH = 5,61g
MKOH = 56,11g/mol
![]()
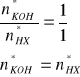
Początkowa liczność KOH jest około sześć rany większa niż sumaryczna liczność obydwu kwasów, zatem obydwa kwasy zostaną zobojętnione, a w roztworze po reakcji pozostanie nadmiar nieprzereagowanego KOH. Zatem:
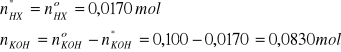
I = 3A, pKw = 14,20, pcH = ?
Obliczamy stężenie KOH w roztworze po reakcji, zakładając addytywność objętości:
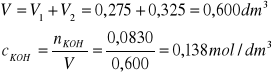
pcOH = 0,86
pcH = pKw - pcOH = 14,20 - 0,86 = 13,34
14/131
V1 = 50 cm3 KOH, pcH1 = 10,78
VNaClO4 = ?, ΔpcH = 0,38
Dodany roztwór NaClO4 nie zawiera KOH, zatem wyjściowy roztwór KOH jest rozcieńczany, w wyniku czego pcH maleje o 0,38 jednostki.
V2 = V1 + VNaClO4 , pcH2 = pcH1 - 0,38 = 10,40
I = 3A, pKw = 14,20
pcOH = pKw - pcH; [OH-] = 10-pcOH ∙co
pcOH1 = 3,42, [OH-]1 = 3,8∙10-4 mol/dm3
pcOH2 = 3,80, [OH-]2 = 1,6∙10-4 mol/dm3
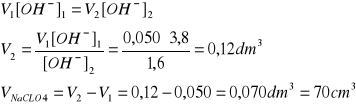
18/132
Kwas octowy, CH3COOH, dalej oznaczony jako HA
cHA = 0,020 mol/dm3, pcH = 3,13
HA ↔ H+ + A-
[H+] = 10-pcH ∙ co = 10-3,13∙ co = 7,4∙10-4 mol/dm3
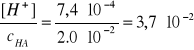
α = 3,7%
20/132
Kwas cyjanowodorowy, HCN, dalej oznaczony jako HA
cHA = 1,66 mol/m3 = 1,66∙10-3 kmol/m3
I = 2A, pKa = 8,52, Ka = 3,02∙10-9
HA ↔ H+ + A-
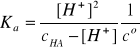
Założenie: cHA>>[H+]
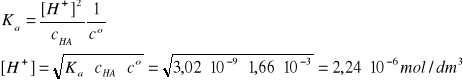
Założenie jest świetnie spełnione, bowiem cHA jest 741 razy większe od [H+].
pcH = - log[H+]/co = 6 - log 2,24 = 5,65
21/132
Roztwór NH3: p[%]NH3 = 2,7%, d = 1,15 g/cm3
MNH3 = 17,03 g/mol
V ≡ 1dm3 = 1000 cm3
![]()
Przyjmujemy, że NH3 w wodzie daje NH4OH, przy czym cNH3 = cNH4OH.
NH4OH ↔ NH4+ + OH-
I = 2A, pKb = 4,40, Kb = 3,98∙10-5, pKw = 13,97
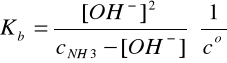
Założenie: cNH3 >>[OH-]
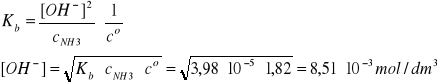
![]()
Założenie jest b. dobrze spełnione, ponieważ cNH3 jest 214 razy większe od [OH-].
pcOH = -log [OH-]/co = 3 - log 8,51 = 2,07
pcH = pKw - pcOH = 13,97 - 2,07 = 11,90
22/131
HCOOH↔H+ + HCOO-, ogólnie HA ↔ H+ + A-
I = 3A, pKa = 3,90 w T = 298 K; Ka = 1,26·10-4 (trzy cyfry znaczące)
p[%]HA = ?, Vr ≡ 1dm3, dr = 1,22 g/cm3, pcH = 1,79
[H+] = 10-pcH ∙co = 0,0162 mol/dm3 (trzy cyfry znaczące)
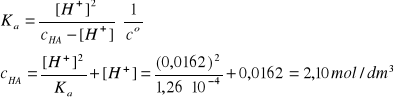
nHA = Vr∙cHA = 2,10 mol, MHCOOH = 46,03 g/mol
mHA = 2,10∙46,03 = 96,7 g
p[%]HA = 100∙mHA/mr = 100∙mHA/Vr∙dr = 100∙96,7/1220 = 7,9% (dwie cyfry znaczące)
23*/132
A - kwas solny
HCl→H+ + Cl-, pcH1 = 4,26,
pcH = -log[H+]/co = -logcHCl/co; cHCl = 10-pcH ·co = 5,50·10-5 mol/dm3
R = 25, c'HCl = cHCl/R = 2,20·10-6 mol/dm3
pcH2 = - log c'HCl/co = 5,65
B - kwas cyjanowodorowy
HCN↔H+ + CN-, pcH1 = 4,26
I = 2A, pKa = 8,52; Ka = 3,02·10-9
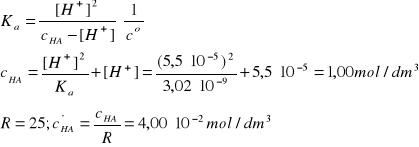
Założenie: c'HA>>[H+]'
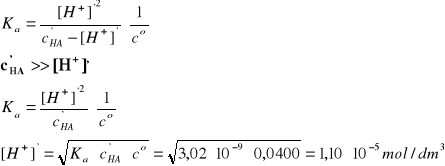
Założenie jest znakomicie spełnione, c'HA jest 3636 razy większe od [H+]'.
pcH2 = -log [H+]'/co = 4,96
28*/132
HClO2 ↔ H+ + ClO2-
I = 1A, pKa = 1,61 w T = 298 K, Ka =2,45·10-2
α = 46,0% czyli 0,460
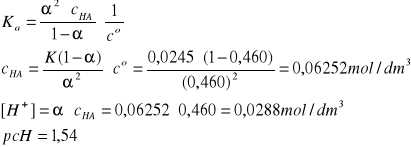
29*/132
HN3 ↔H+ + N3-
I = 3A, pKa = 4,78 w T = 298 K, Ka = 1,66·10-5
R1: V1 = 100 cm3, c1 = 0,10 M HN3
R2: V2 = 100 cm3 HN3 o pcH = 2,69
[H+]2 = 2,04·10-3 mol/dm3 (trzy cyfry znaczące)
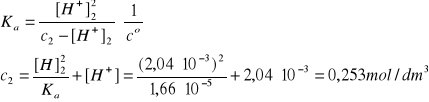
R3: Zakładamy addytywność objętości V3 = V1 + V2 = 0,200 dm3.
Obliczamy liczność kwasu azotowodorowego w uzyskanym roztworze:
nHN3 = V1c1 + V2c2 = 0,100·0,10 + 0,100·0,253 = 0,0353 mol
c3 = nHN3/V3 = 0,0351/0,200 = 0,176 mol/dm3
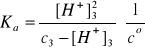
Założenie: c3 >> [H+]3; [H+]3 = (Kac3)1/2 = 1,71·10-3 mol/dm3
Powyższe założenie jest spełnione, c3 jest 103 razy większe od [H+]3. Zatem: α = [H+]3/c3 = 0,0097 lub 0,97%.