KINETYKA REAKCJI ENZYMATYCZNYCH
Wyznaczanie stałej Michaelisa (KM) na przykładzie kwaśnej fosfatazy (EC 3.1.3.2)
WSTĘP
Kinetyka enzymatyczna stanowi dział enzymologii zajmujący się badaniem szybkości reakcji enzymatycznych (gr. kinezis - ruch) oraz wpływu na nią różnych czynników. Podstawą kinetyki enzymatycznej jest analiza aktywności enzymu, której miarę stanowi szybkość katalizowanej przez enzym reakcji. Wyraża się ją przyrostem ilości produktów
lub spadkiem stężenia substratu w jednostce czasu. Na przebieg reakcji enzymatycznej wpływa wiele czynników chemicznych i fizycznych, takich jak budowa i stężenie enzymu, stężenie substratu, temperatura, pH, stężenie aktywatorów i inhibitorów.
W celu poznania ogólnego mechanizmu działania enzymu, szczególnie istotne jest badanie wpływu stężenia substratu na szybkość reakcji enzymatycznej.
Rys. 1. Zależność szybkości reakcji enzymatycznej od stężenia substratu (przy stałym stężeniu
enzymu).
Dla wielu enzymów zależność szybkości reakcji (v) od stężenia substratu (S) może być wyrażona prostą zależnością matematyczną, której obrazem graficznym jest hiperbola (Rys. 1).
Dane kinetyczne przedstawione na powyższym rysunku opisuje równanie Michaelisa-Menten
Vmax [S]
v =
KM + [S]
Stała Michaelisa (KM) jest charakterystyczna dla każdego enzymu i określa zależność między stężeniem substratu i szybkością reakcji. W szczególnych warunkach stała ta może opisywać powinowactwo enzymu do danego substratu. Wartość liczbowa KM odpowiada takiemu stężeniu substratu (S), przy którym szybkość reakcji osiąga połowę szybkości maksymalnej (Vmax). Dla większości enzymów wyznaczone wartości KM mieszczą się w przedziale 10-1 ÷ 10-6 M.
Jeśli enzym działa zgodnie ze schematem, którego graficznym obrazem jest zależność przedstawiona na Rys. 1, to możemy wyznaczyć KM dla tego enzymu wykonując pomiary szybkości początkowej (tzn. w stosunkowo krótkim czasie, gdy ilość przekształconego substratu jest proporcjonalna do czasu działania enzymu), przy różnych stężeniach substratu. Jest to szczególnie proste, gdy równanie Michaelisa-Menten przedstawimy w formie odwrotności:
1 = 1 + KM × 1
v Vmax Vmax [S]
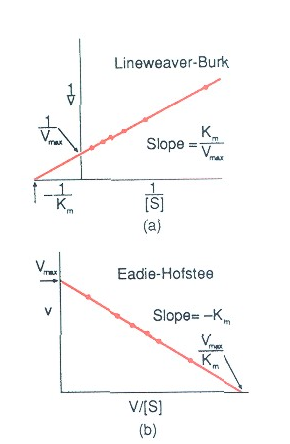
W wyniku tego przekształcenia otrzymujemy równanie Lineweavera-Burka, którego wykresem jest linia prosta (Rys. 2a).
Rys. 2. Graficzne wyznaczenie KM i Vmax metodą Lineweavera-Burka i Eadie-Hofstee.
Zdecydowanie lepszym, z uwagi na równe rozłożenie punktów opisujących prostą, sposobem graficznego wyznaczania wartości Vmax i KM jest metoda Eadie-Hofstee zwana również metodą Woolf-Augustinsson-Hofstee (Rys. 2b). Opisuje ją następujące przekształcenie równania Michaelisa-Menten:
Vmax = v (KM/[S] + [S]/[S])
Vmax = v KM / [S] + v
v = - v KM /[S] + Vmax
Wartość Vmax odczytujemy bezpośrednio z wykresu w miejscu przecięcia się prostej
z osią y, natomiast wartość KM obliczamy z nachylenia prostej KM = tgα = y/x.
Zasada oznaczania aktywności kwaśnej fosfatazy
Kwaśna fosfataza (EC 3.1.3.2) należy do klasy hydrolaz i katalizuje reakcję odszczepienia reszty fosforanowej od cukrowców, białek, tłuszczowców, nukleotydów i innych naturalnych estrów fosforanowych. Enzym ten hydrolizuje również estry fosforanowe fenoli, np. p-nitrofenylofosforan. Fosfataza hydrolizując ten związek uwalnia p-nitrofenol, który w środowisku alkalicznym ma barwę żółtą. Natężenie barwy mierzone przy długości
fali λ = 405 nm jest proporcjonalne do ilości zhydrolizowanego substratu.
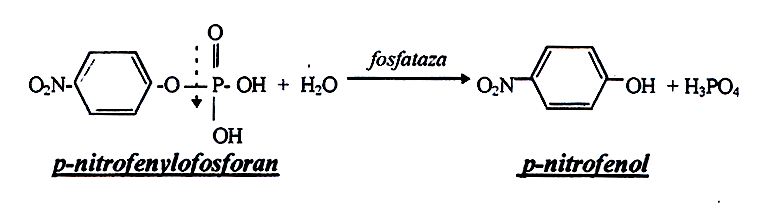
Fosfataza kwaśna jest enzymem lizosomalnym, glikoproteiną zawierającą około 13% węglowodanów. W organizmie człowieka występuje wiele izoform fosfatazy kwaśnej. Wzrost aktywności izoformy sterczowej (PAP) w surowicy ludzkiej wskazuje na zmiany nowotworowe w prostacie. Inna izoforma kwaśnej fosfatazy jest markerem resorpcji (destrukcji) kości.
MATERIAŁ I METODY
Odczynniki:
0,25 M bufor Tris-octan pH 5,5
0,5 M bufor Tris-octan pH 5,5
1 mM p-nitrofenol w 0,25 M buforze Tris-octan pH 5,5
1 mM p-nitrofenylofosforan w 0,5 M buforze Tris-octan pH 5,5
10 mM p-nitrofenylofosforan w 0,5 M buforze pH 5,5
0,1 M NaOH
0,9 % NaCl
wyciąg z ziemniaka
WYKONANIE
Wyznaczanie krzywej standardowej dla p-nitrofenolu
Z roztworu podstawowego (1mM p-nitrofenol w 0,25 M buforze Tris-octan pH 5,5) przygotuj po 2 ml roztworów o następujących stężeniach: 0,05 mM; 0,1 mM; 0,2 mM; 0,3 mM;
0,4 mM; 0,5 mM. Do 12 suchych probówek wlej po 0,5 ml roztworów p-nitrofenolu
o odpowiednim stężeniu (przygotuj 2 próby dla każdego stężenia). Próba kontrolna zawiera 0,5 ml 0,25mM buforu Tris-octan pH 5,5. Do wszystkich prób dodaj po 2,5 ml 0,1 M NaOH. Natężenie uzyskanej barwy zmierz przy λ = 405 nm wobec próby kontrolnej.
Na podstawie otrzymanych wyników wykreśl krzywą kalibracyjną, odkładając na osi rzędnych absorbancję, a na osi odciętych stężenie p-nitrofenolu.
Oblicz współczynnik kalibracji:
stężenie p-nitrofenolu [μmole/ml]
K = 1 cm
A 405nm
B. Przygotowanie wyciągu z ziemniaka
Obrany i umyty ziemniak zetrzeć na tarce, przesączyć przez warstwę nylonu. Rozcieńczyć 100 razy 0,9 % roztworem NaCl do objętości 25 ml (w kolbce).
C. Badanie wpływu stężenia substratu na aktywność katalityczną kwaśnej fosfatazy. Wyznaczanie stałej Michaelisa (KM).
Przygotowanie roztworów substratu
Z 1 mM roztworu p-nitrofenylofosforanu w 0,5 M buforze Tris-octan pH 5,5 przygotuj po 1 ml roztworów o następujących stężeniach: 0,2 mM, 0,4 mM 0,6 mM, i 0,8 mM i 1 mM. Używając 10 mM roztworu tego substratu przygotuj po 1 ml roztworów o stężeniach: 2 mM; 4 mM; 6 mM; 8 mM. Do przygotowania roztworów użyj 0,5 M w buforu Tris-octan pH 5,5.
Wykonanie oznaczenia
Do 27 probówek dodaj po 0,25 ml substratu o odpowiednim stężeniu (9 x 2 = 18 prób badanych + 9 prób kontrolnych dla każdego stężenia substratu). Wszystkie próby umieścić
w termostacie o temperaturze 370C na 5 minut, po czym rozpocznij reakcję dodając po
0,25 ml odpowiednio rozcieńczonego enzymu. Próby inkubuj 15 minut. Reakcję przerwij dając do każdej próby 2,5 ml 0,1 M NaOH. Do prób kontrolnych z substratem po 15 minut inkubacji dodaj 2,5 ml 0,1 M NaOH a następnie 0,25 ml enzymu. Zamieszaj!
Dokonaj pomiaru fotometrycznego przy λ = 405 nm wobec odpowiednich prób kontrolnych.
OPRACOWANIE WYNIKÓW
A. Posługując się krzywą standardową lub korzystając ze współczynnika kalibracji, oblicz szybkość reakcji (v), odpowiadającą ilości p-nitrofenolu uwolnionego w każdej próbie
w ciągu 1 min reakcji (μmole x min-1 x ml-1).
B. Sporządź wykres zależności szybkości reakcji od stężenia substratu. UWAGA! Przed sporządzeniem wykresu należy obliczyć stężenie substratu w mieszaninach reakcyjnych.
C. Oblicz odwrotności stężeń substratu (1/[S]) i odwrotności szybkości reakcji (1/V) przy danym stężeniu substratu. Na podstawie tych danych sporządź wykres Lineweavera-Burka. Odczytaj z wykresu 1/KM i oblicz wartość stałej Michaelisa (KM) oraz Vmax.
D. Oblicz wartość v/[S] i sporządź wykres Eadie-Hofstee. Odczytaj z wykresu wartość Vmax
i korzystając z wykresu oblicz KM. Oceń przydatność obu metod w analizie wartości KM i Vmax enzymów.
5
Wyszukiwarka
Podobne podstrony:
dehydrogenaza bursztynianowa enzymol, [ ARCHIWA ], [ 2008-2009 ], Enzymologia, instrukcje
Raport selekcja szczepów K.K., [ ARCHIWA ], [ 2008-2009 ], Biotechnologia, Zakład BT-MB
raport - przechowywanie szczepów - A.G., [ ARCHIWA ], [ 2008-2009 ], Biotechnologia, Zakład BT-MB
5) Czynniki warunkujące aktywność enzymów na przykładzie fosfatazy kwaśnej
Czynniki warunkujące aktywność enzymów na przykładzie fosfatazy kwaśnej
Liga zadaniowa 16 II 2009, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa - 24 XI 2008 - rozwiązania, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa - 6 XI 2008 - rozwiązania, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa - 6 XI 2008, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa - 24 XI 2008, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa - 15 XII 2008, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa 16 II 2009, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Wzorniki cz 3 typy serii 2008 2009
download Prawo PrawoAW Prawo A W sem I rok akadem 2008 2009 Prezentacja prawo europejskie, A W ppt
choroby trzustki i watroby 2008 2009 (01 12 2008)
Egzamin 2008 2009
geografia konkurs gim 2008 2009
więcej podobnych podstron