Politechnika Krakowska WIiTCh
|
Sprawozdanie z ćwiczenia numer 3 |
Data:
|
|
Destylacja |
Ocena: |
1. Wstęp teoretyczny
Destylacja jest prostą metodą rozdziału składników mieszaniny. Jej działanie opiera się na wykorzystaniu różnicy w lotności poszczególnych składników mieszaniny i ma na celu wzbogacenie mieszaniny w składnik bardziej lotny.
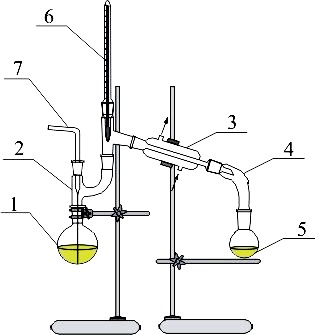
Schemat aparatury:
Kolba z substancją którą chcemy destylować
Nakładka
Chłodnica
Nakładka
Kolba do odbioru destylatu
Termometr
Para i ciecz są w stanie równowagi termodynamicznej gdy ich potencjały są sobie równe:
μc,A =μp,A, gdzie:
μc,A- potencjał chemiczny składnika A roztworu w cieczy
μp,A- potencjał chemiczny składnika A roztworu w parze
Dla roztworu doskonałego znajdującego się w stanie równowagi obowiązuje prawo Raoulta:
pA=PA·xA, gdzie:
pA- ciśnienie cząstkowe składnika A nad roztworem(np.A-B) [mmHg]
PA- prężność par nasyconych czystego składnika A [mmHg]
xA- ułamek molowy składnika A w cieczy [kmol/kmol]
Z prawa Daltona wiemy, że:
pA= p·yA, gdzie:
p- ciśnienie całkowite wywierane na układ z zewnątrz [mmHg]
yA- ułamek molowy składnika A w parze [kmol/kmol]
Łącząc te dwa równania znajdujemy zależność między ułamkiem molowym składnika w cieczy i w parze:
yA= (PA/p)·xA
Jeżeli roztwór jest doskonały- spełnia prawo Raoult. Przykładem roztworu zachowującego się jak doskonały może być np. roztwór benzen-toluen. Sumaryczna prężność pary nad takim roztworem w funkcji ułamka molowego składników ma charakter liniowy.
Roztwory rzeczywiste wykazują jednak odchylenia od prawa Raoulta:
Dodatnie odchylenia obserwujemy wtedy, gdy sumaryczna prężność pary jest większa niż to wynika z prawa Raoulta.
Ujemne, jeśli sumaryczna prężność par nasyconych nad takim roztworem jest mniejsza niż wynika to z prawa Raoulta.
Dla roztworu dwuskładnikowego gdzie xA>>xB, dla substancji A (czyli rozpuszczalnika) obowiązuje prawo Raoulta mimo że roztwór jest niedoskonały, natomiast dla substancji B (czyli substancji rozpuszczonej) obowiązuje prawo Henry'ego mówiące, że:
pB= KH·xB, gdzie:
KH- stała Henry'ego charakterystyczna dla danej substancji.
Destylacja którą przeprowadzam w laboratorium to destylacja IZOBARYCZNA.
2. Opis wykonania ćwiczenia
1. Przygotowujemy roztwór heksan-toluen z 40 cm3 heksanu i 10 cm3.
2. Badamy jego współczynnik załamania światła, a następnie umieszczamy w zestawie do destylacji.
3.Włączam obieg wody w chłodnicy następnie podłączam zestaw destylacyjny do prądu.
4. Doprowadzam układ do wrzenia i gdy ustali się temperatura wrzenia utrzymujemy układ tym stanie 10-15 minut.
5. Odłączam dopływ prądu następnie gdy ciecz przestaje wrzeć pobieram próbkę destylatu i badamy jego współczynnika załamania światła.
6. Przeprowadzamy doświadczenie jeszcze raz
3. Zestawienie wyników
Dane:
Prężność pary heksanu przy ciśnieniu atmosferycznym: 68,7oC
Prężność pary toluenu przy ciśnieniu atmosferycznym: 110,6oC
Ciśnienie w dniu pomiaru: 760 mmHg
L.p. |
Temp. wrzenia [ºC] |
Współczynnik załamania światła cieczy |
Współczynnik załamania światła destylatu |
Ułamek molowy toluenu w cieczy |
Ułamek molowy toluenu w destylacie |
0* |
- |
1.4075 |
- |
0,26 |
- |
1 |
75 |
1,4083 |
1.3901 |
0,28 |
0,13 |
2 |
73 |
1,4125 |
1,3858 |
0,32 |
0,1 |
*przed rozpoczęciem destylacji
Teoretyczny skład pary wyrażony ułamkiem molowym toluenu obliczony z prawa Raoulta i Daltona (yA= (PA/p)·xA) w oparciu o wartości prężności pary nasyconej toluenu wynosi:
- przy pierwszej próbie ![]()
-przy drugiej próbie ![]()
Teoretyczny skład pary wyrażony ułamkiem molowym heksanu obliczony z prawa Raoulta i Daltona (yA= (PA/p)·xA) w oparciu o wartości prężności pary nasyconej toluenu wynosi:
- przy pierwszej próbie ![]()
-przy drugiej próbie ![]()
Toluen |
xT |
yT (doświadczalnie) |
PT [mmHg] |
pA [mmHg] |
yT (wyliczony) |
Pierwsza destylacja |
0,26 |
0,13 |
300 |
78 |
0,10 |
Druga destylacja |
0,28 |
0,10 |
275 |
77 |
0,10 |
Heksan |
xH |
yH (doświadczalnie) |
PH [mmHg] (wyliczona z p. Raoulta) |
pH [mmHg] (wyliczone z p. Daltona) |
yH (wyliczony) |
Pierwsza destylacja |
0,74 |
0,87 |
922 |
682 |
0,90 |
Druga destylacja |
0,72 |
0,90 |
946 |
681 |
0,90 |
Wykres prężności pary od temperatury:
4. Wnioski
Z powodu skróconego czasu zajęć wykonałyśmy małą ilość pomiarów. Doświadczeniem udało nam się potwierdzić, że heksan jest substancją bardziej lotną od toluenu. Duża różnica w składzie pary po pierwszej destylacji wynika z przypadkowego zmieszania par z cieczą, która zebrała się w okolicach odpływu pary (złe ustawienie korka). Druga destylacja została przeprowadzona prawidłowo. Po wynikach doświadczenia można stwierdzić, że destylacja nie jest bardzo sprawną metodą rozdzielania substancji. Podgrzewanie jest czasochłonne, a rozdział substancji (pomimo znacznej różnicy w temperaturze wrzenia) nastąpił w niewielkim stopniu.
Nasze pomiary są obarczone błędem wynikającym z następujących faktów:
Niedokładne odmierzenie toluenu wynikające z tego, że najniższą wartością na cylindrze było 20 cm3
Nieszczelność aparatury podczas pierwszego pomiaru
Wyszukiwarka
Podobne podstrony:
Prezentacja Spadki WSZiB KRaków
ANALIZA RYNKU NIERUCHOMOŚCI KOMERCYJNYCH W KRAKOWIE W LATACH 2008 2012
KRAKÓW
PODSTAWY MARKETINGU WSZIB KRAKÓW Handel detaliczny Handel hurtowy
PODSTAWY MARKETINGU WSZIB KRAKÓW Sprzedaż osobista Promocja sprzedaży
Kazusy część ogólna WSZiB Kraków
destylacja 2 12 2, 2 12 3
cud mniemany, czyli krakowiaki i górale w bogusławski ZSSQNTR22DFIX2LPTY4OJ5XS2ZQSNGP7PBNOQZA
Krakow nowapr2 Nowa ark I proba Nieznany
KA Admin Publ i Sąd nst Podstawy pr pracy 2011 - 2012, Studia na KA w Krakowie, 4 semestr, Prawo pra
kraków dawna stolica polski 16.03, ozdoby z makaronu, konpekty świetlica, Dokumenty
RACHUNKOWOŚĆ WSZIB KRAKÓW SEMESTR II - POPRAWIANIE BŁĘDÓW KSIĘGOWYCH, Dokumenty(1)
zasady zawierania kontraktu, Studium Psychoterapii Uzależnień Kraków
Ćw 3 Destylacja i rektyfikacja w przemyśle spożywczym, Studia, Jakość, OTŻ, OTŻ, Destylacja i rektyf
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Kancelaria grodzka w Krakowie w latach 1572, ARCHIWISTYKA, Archiwistyka(1)
więcej podobnych podstron