Struktura i funkcja lipidów w organizmie
• Budowa i właściwości kwasów tłuszczowych
kwasy monokarboksylowe o wzorze ogólnym R-COOH, zazwyczaj o prostym łańcuchu węglowodorowym
zawierają 4-28 atomów węgla (czasem pojęcie to rozszerza się na wszystkie alifatyczne niecykliczne kwasy karboksylowe).
z powodu przewagi części hydrofobowej (łańcuch) nad hydrofilową (grupa COOH) są nierozpuszczalne w wodzie
mają neutralne pH.
często oznacza się w notacji n:m, gdzie n to liczba atomów węgla w cząsteczce (wliczając w to atom zawarty w grupie karboksylowej), zaś m to liczba wiązań podwójnych między nimi.
posiadają parzystą liczbę atomów węgla
• Nazewnictwo i podział kwasów tłuszczowych
nasycone
nie zawierają podwójnych wiązań w cząsteczce.
w warunkach normalnych są zwykle białymi ciałami stałymi.
zawierające w łańcuchu więcej niż 10 atomów węgla są nierozpuszczalne w wodzie i są nielotne.
Przykładowe nasycone kwasy tłuszczowe :
Nienasycone
zawierają wiązania podwójne.
zwykle bezbarwne ciecze.
w większości wszystkie wiązania podwójne są w pozycji cis, a po każdym wiązaniu podwójnym następuje 3n (gdzie n = 1, 2, 3...) atomów węgla.
Naturalnie występują w formie cis. Sztucznie wytwarzana forma trans jest szkodliwa dla zdrowia
W przypadku nienasyconych kwasów tłuszczowych nie wystarcza notacja n:m. Należy też wskazać położenie wiązań podwójnych, co można zrobić na dwa sposoby:
wielonienasycone kwasy tłuszczowe,
zawierają więcej niż jedno wiązanie podwójne.
Dzielimy na omega 6 (rodzina kwasu linolowego) i omega 3 (rodzina kw. alfa - linolowego)
niezbędny elementem diety człowieka (stanowią grupę tzw. witamin F, inaczej egzogenne lub niezbędne kwasy tłuszczowe), gdyż są nam potrzebne do tworzenia ważnych związków (np. prostaglandyn), a nie są syntezowane przez nasze organizmy (mogą je syntezować jedynie rośliny).
kwasy jednonienasycone (monoenowe),
zawierające jedno wiązanie podwójne:
kwas oleopalmitynowy 16C (zawierający 16 atomów węgla w cząsteczce)
kwas oleinowy 18C - stały składnik tł. roślinnych i zwięrzęcych
kwasy dwunienasycone (dienowe), zawierające 2 wiązania podwójne:
kwasy trójnienasycone (trienowe), zawierające 3 wiązania podwójne:
kwasy czteronienasycone (tetraenowe), zawierające 4 wiązania podwójne:
związki chemiczne, w których 1, 2 lub wszystkie 3 grupy hydroksylowe (-OH) gliceryny zostały zestryfikowane kwasami karboksylowymi.
wyróżniamy mono-, di- i triacyloglicerole.
powszechne w organizmach żywych, głównie jako tłuszcze, a także jako regulatory procesów biochemicznych oraz produkty przemiany materii.
Po estryfikacji grup hydroksylowych glicerolu różnymi kwasami tłuszczowymi, środkowy atom węgla(C2)glicerolu staje się asymetryczny.(normalnie glicerol nie jest czynny optycznie)
drugorzędowa grupa hydroksylowa połoŜona jest z lewej strony asymetrycznego atomu węgla
główne składniki tłuszczów zapasowych
biochemicznie pokrewnymi związkami są alkiloglicerole, w których zamiast wiązania estrowego występuje wiązanie eterowe.
Wzór ogólny :
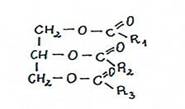
monoacyloglicerolediacyloglicerole

emulgatory w przemyśle spożywczym, np. w wypiekach, lodach, gumie do żucia i in.lipidy sygnałowe
substraty w biosyntezie prostaglandyn
stymulacja kinazy białkowej C
prekursory endokannabinoidu 2-arachidonoiloglycerolu (monoacyloglicerolu).
triacyloglicerole
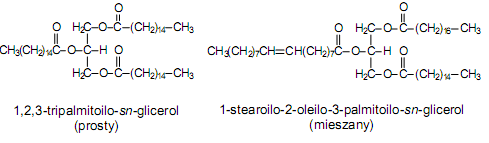
główny materiał energetyczny zużywany na bieżące potrzeby organizmumagazynowane jako materiał zapasowy w postaci tkanki tłuszczowej.
hydrofobowe, nierozpuszczalne w wodzie, nie tworzą rozproszonych miceli, są natomiast rozpuszczalne w chloroformie, benzenie, eterze i gorącym etanolu.
z długołańcuchowymi, nasyconymi kwasami tłuszczowwymi - substancje stałe (tłuszcze zwierzęce)
zawierające nienasycone kwasy tłuszczowe - ciecze (oleje roślinne)
obniŜenie temperatury topnienia tłuszczów przez kwasy nienasycone jest konsekwencją zgiętego kształtu ich łańcuchów węglowodorowych - zgięte łańcuchy nie wypełniają szczelnie przestrzeni - tak jak łańcuchy wyprostowane nasyconych kwasów - co pociąga za sobą zmniejszenie oddziaływań międzycząsteczkowych i temperatury topnienia.
proste - posiadają trzy identyczne kwasy tłuszczowe
złożone (mieszane) - posiadają różne kwasy tłuszczowe w cząsteczce
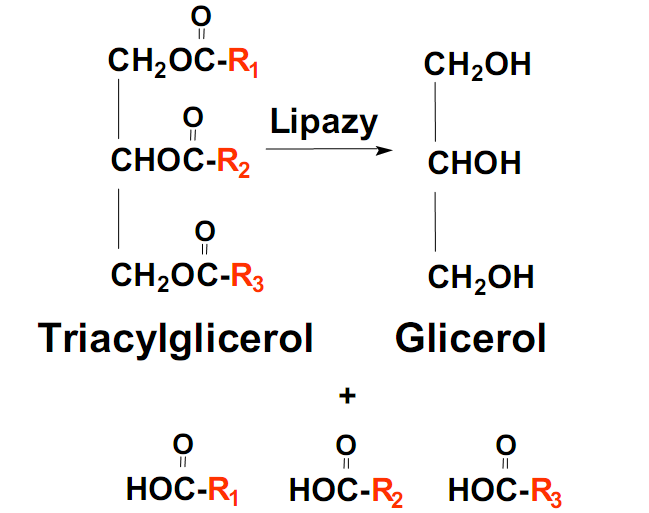
Zachodzi w dwunastnicyUłatwiane jest przez sole kwasów żółciowych (emulgacja) i środowisko zasadowe (sok trzustkowy)
reuglacja procesu lipalizy
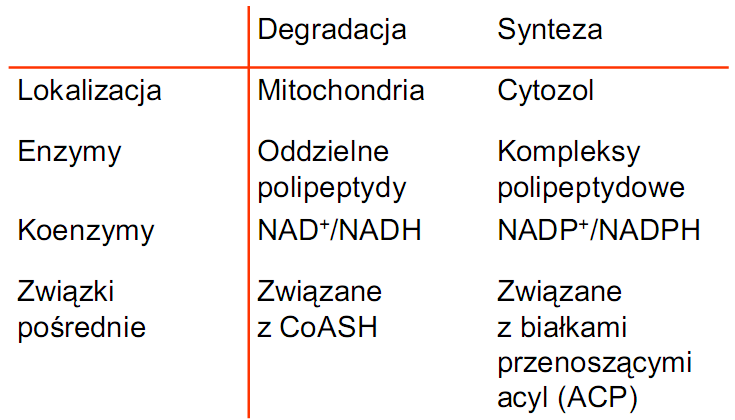
synteza w cytoplazmie
utlenianie w mitochondrium
krótkowęglowe swobodnie przenikają przez bł mitochondrium
długowęglowe przechodzą dzięki karnitynie - przenośnik w bł. mitochondrium
na terenie matrix - reszty acylowe odbiera CoA → acetylo-CoA
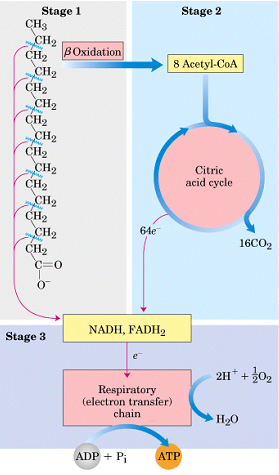
β - oksydacja składa się z rund, które dzielimy na fazy
1 etap - utlenianie
2 etap - uwodnienie
3 etap - utlenianie
4 etap - tioliza
Aktywacja kwasu tłuszczowego poprzez estryfikację CoASHTransport acylo-CoA przez błonę mitochondrium
Reakcje procesu β-oksydacji
CPT I jest MAŁO AKTYWNA w stanie sytości (a aktywna w stanie głodu)
silnym inhibitorem CPT I jest Malonylo-CoA (związek pośredni w biosyntezie kw. tłuszczowych, powstaje w wyniku działania karboksylazy Acetylo-CoA)
regulacja ilością FFA (im więcej tym większa ketogeneza) i bilansem energetycznym komórki.
ketogeneza jest takim mechanizmem, który pozwala wątrobie utlenić zwiększające się ilości kwasów tłuszczowych bez zwiększania całkowitego wydatku energetycznego
Biosynteza
zachodzi we wszystkich komórkach jądrzastych, lecz głównie w wątrobie (60-70%), jelitach (15%) oraz w skórze (5%).e
ndogenny cholesterol syntetyzowany jest z tego samego źdódła, co kwasy tłuszczowe: z acetylo-CoA. Tworzenie tej cząsteczki z fragmentów dwuwęglowych przebiega w kilku etapach.
2 cząsteczki acetylo-CoA reagują ze sobą w reakcji katalizowanej przez enzym tiolazę cytozolową. W rezultacie powstaje acetoacetylo-CoA i wolny CoA. Acetoacetylo-CoA może też powstać w inny sposób.
Acetoacetylo-CoA kondensuje z kolejną cząsteczką acetylo-CoA. Tym razem funkcję katalizatora pełni syntaza HMG-CoA. Kolejny wolny CoA ulega odszczepieniu, głównym produktem reakcji jest zaś 3-hydroksy-3-metyloglutarylo-CoA (β-hydroksy-β-metyloglutarylo-CoA, w skrócie HMG-CoA)
3-hydroksy-3-metyloglutarylo-CoA ulega redukcji, dzięki czemu odłącza się ostatnia, 3. cząsteczka koenzymu A. Równoważników redukcyjnych (atomów wodoru) dostarcza NADPH, czyli zredukowana postać fosforanu dinukleotydu nikotynoamidoadeninowego. Utlenia się ona do NADP+. Proces katalizuje reduktaza HMG-CoA. W jego efekcie powstaje mewalonian.
Mewalonian posiada 6 atomów węgla, powstał bowiem z 3 reszt acetylowych. Do syntezy pierścienia steroidowego używana jest jednaj grupa pięciowęglowa, tzw. jednostka izoprenoidowa nazwana tak od węglowodoru posiadającego podobny szkielet węglowy. Mewalonian musi pozbyć się jednego atomu węgla.
jest to bardzo kosztowne energetycznie, a zachodzi dzięki 3 działąjącym po sobie kinazom. Jako 1. bierze w tym udział kinaza mewalonianowa, fosforylując substrat przy 5. atomie węgla - powstaje 5-fosforan mewalonianu, który zostaje ufosforylowany po raz wtóry przez kinazę fosfomewalonianową, która z kolei czyni z niego 5-difosforan mewalonianu. Ten zaś ulega 3., ostatniemu już przeniesieniu grupy ortofosforanowej, dzięki czemu utworzeniu ulega 3-fosfo-5-difosforan mewalonianu. Dzieje się to dzięki kinazie difosfomewalonianowej. Fosforylacje te zużyły 3 cząsteczki ATP, czyniąć z nich 3ADP.
Utworzony tym sposobem 3-fosfo-5-difosforan mewalonianu ulega dekarboksylacji, oprócz dwutlenku węgla odłączając także jedną z grup fosforanowych. W efekcie powstaje więc difosforan izopentenylu zwany także izopentenylodifosforanem. Przejście to przeprowadza dekarboksylaza difosfomewalonianowa.
Część cząsteczek difosforanu izopentenylu ulega izomeryzacji katalizowanej przez izomerazę izopentenylodifosforanową do difosforanu 3,3-dimetyloallilu. Cały ten proces polega po prostu na zmianie położenia wiązania podwójnego
difosforan izopentenylu i difosforan 3,3-dimetyloallilu kondensują dzięki cis prenylotransferazie, tworząc difosforan geranylu. Związek ten posiada już 10 atomów C.
Difosforan geranylu łączy się z kolejną cząsteczką difosforanu izopentenylu, dzięki czemu powstaje difosforan farnezylu o 15 atomów C. Może on wejść w kilka różnych szlaków metabolicznych, np. tworząc dolichol albo łańcuch boczny ubichinonu. By stać się w końcu cholesterolem albo innym sterydem, musi on jednak zostać połączony z 2. taką samą cząsteczką przez syntetazę skwalenu. Potrzebny jest także NADPH. W rezultacie powstaje liczący 30 atomów węgla skwalen. Mechanizm tej reakcji obejmuje utworzenie difosforanu preskwalenu, który jest redukowany i odłącza pirofosforan.
epoksydaza skwalenowa przy udziale tlenu, NADPH i FAD (dinukleotydu flawinoadeninowego) utlenia pierwsze wiązanie podwójne licząc od początku łańcucha (terminalne[6]), tworząc pierścień trójczłonowy charakterystyczny dla epoksydów. Powstały epitlenek nazywamy oksydoskwalenem[10] albo tlenkiem cholesterolu[6].
lanosterolocyklaza oksydoskwalenowa (cyklaza oksydoskwalen : lanosterol) powoduje zamknięcie się łańcucha w 3 pierścienie cykloheksanowe i 1 cyklopentanowy z przemieszczeniem grup metylowych przy C14 i C8 na odpowiednio C13 i C14 (tak więc C14 traci jedną grupę metylową i zyskuje nową). W efekcie powstaje 30-węglowy związek zwany lanosterolem.[10]
mechanizm opiera się na karbokationach. Uprotonowanie atomu węgla mającego stać się 4. w cząsteczce cholesterolu czyni go podatnym na atak nukleofilowy atomu tworzącego położone blisko wiązanie podwójne (późniejszy C5). Ładunek dodatni gromadzi się więc na węglu sąsiednim (później 10), który przyciąga elektrony kolejnego wiązania podwójnego. W rezultacie karbokation przenosi się na przyszły C8 i sytuacja się powtarza. Przeniesienie tych 3 wiązań owocuje utworzeniem 3 pierścieni cykloheksanowych. Następnie obdarzony ładunkiem dodatnim węgiel, któremu przypisany zostanie nr 13, reaguje z przedostatnim wiązaniem podwójnym, tworząc pierścień pięcioczłonowy. Ładunek z C20 zamienia się miejscami z atomem wodoru z C17, a następnie C13. Prezgrupowanie w obrębie karbokationu przenosi tam grupę metylową (będzie to C19), jej poprzednie miejsce (przy C14) zajmuje kolejna grupa metylowa złączona wcześniej z C8. Po kolejnej zmianie umiejscowienia ładunku karbokation rozpada się, przekazując kation wodoru jakiejś zasadzie i tworząc wiązanie podwójne. W ten sposób utworzona zostaje cząsteczka lanosterolu. Opisane tutaj po kolei kojne cyklizacje prawdopodobnie zachodzą jednocześnie, podobnie jak przegrupowania karbokationu i utrara H+.[6]
Lanosterol posiada już grupę hydroksylową przy C3, ale dysponuje także nadmiarowymi grupami metylowymi, a jego wiązanie podwójne jest w złym miejscu. Musi więc nastąpić utlenienie wspomnianych grup do dwutlenku węgla, a wiązanie podwójne powinno zmienić pozycję. Jako kolejne stadia tego procesu zaproponowano:14-demetylolanosterol, zymosterol, Δ7,24, cholestadienol, desmosterol - ten zaś pod wpływem Δ7,24-reduktazy zamienia się w cholesterol.
Znaczenie biologiczne
synteza witaminy D3 oraz hormonów o budowie sterydowej takich jak kortyzon, progesteron, estrogeny i testosteron.
jego obecność w błonach komórek nerwowych mózgu ma duże znaczenie dla funkcjonowania synaps. Istnieją też doniesienia, że odgrywa on dużą rolę w działaniu systemu immunologicznego (odpornościowego).
może działać jako antyoksydant w żółci.
dostarcza on podstawowych struktur wszystkich steroidów.
w mielinie okrywa i izoluje nerwy, pomagając doskonale przewodzić impulsy nerwowe.
bierze udział w formowaniu raft lipidowych i membrany plazmowej.
redukuje przepuszczalność błony komórkowej do kationów wodoru i sodu
istotny dla struktury i funkcjonowania wklęsłych kaweol i wgłębienia osłon klatrynowych, włączając edocytozyny kaweolzależne i klatrynazależne. Rola cholesterolu w takich endocytozynach może być rozpatrywana przy użyciu cyklodekstryny (MβCD), aby usunąć cholesterol z błony komórkowej.
Nazwa zwyczajowa |
Nazwa systematyczna |
Wzór sumaryczny |
|
Temperatura topnienia (°C) |
Kwas masłowy |
Kwas butanowy |
CH3(CH2)2COOH |
C4:0 |
-8 |
Kwas walerianowy |
Kwas pentanowy |
CH3(CH2)3COOH |
C5:0 |
-34,5 |
Kwas kapronowy (masło, kokos) |
Kwas heksanowy |
CH3(CH2)4COOH |
C6:0 |
-3 |
Kwas enantowy |
Kwas heptanowy |
CH3(CH2)5COOH |
C7:0 |
-7,5 |
Kwas kaprylowy |
Kwas oktanowy |
CH3(CH2)6COOH |
C8:0 |
16-17 |
Kwas pelargonowy |
Kwas nonanowy |
CH3(CH2)7COOH |
C9:0 |
12,5 |
Kwas kaprynowy |
Kwas dekanowy |
CH3(CH2)8COOH |
C10:0 |
31 |
- |
Kwas undekanowy |
CH3(CH2)9COOH |
C11:0 |
28-31 |
Kwas laurynowy |
Kwas dodekanowy |
CH3(CH2)10COOH |
C12:0 |
44-46 |
- |
Kwas tridekanowy |
CH3(CH2)11COOH |
C13:0 |
41-42 |
Kwas mirystynowy |
Kwas tetradekanowy |
CH3(CH2)12COOH |
C14:0 |
58.8 |
- |
Kwas pentadekanowy |
CH3(CH2)13COOH |
C15:0 |
51-53 |
Kwas palmitynowy |
Kwas heksadekanowy |
CH3(CH2)14COOH |
C16:0 |
63-64 |
Kwas margarynowy |
Kwas heptadekanowy |
CH3(CH2)15COOH |
C17:0 |
59-61 |
Kwas stearynowy |
Kwas oktadekanowy |
CH3(CH2)16COOH |
C18:0 |
69.9 |
- |
Kwas nonadekanowy |
CH3(CH2)17COOH |
C19:0 |
68-70 |
Kwas arachidowy |
Kwas eikozanowy |
CH3(CH2)18COOH |
C20:0 |
75.5 |
Kwas behenowy |
Kwas dokozanowy |
CH3(CH2)20COOH |
C22:0 |
74-78 |
Kwas lignocerynowy |
Kwas tetrakozanowy |
CH3(CH2)22COOH |
C24:0 |
|
używając notacji Delta-k,l,m... lub Δk,l,m..., gdzie k,l,m... oznaczają położenie wiązania podwójnego licząc od grupy karboksylowej (np. zapis Δ9,12 oznacza, że wiązania podwójne znajdują się przy 9 i 12 atomie węgla) albo używając notacji Omega-n lub Ω-n, gdzie n oznacza położenie ostatniego wiązania podwójnego licząc od końca łańcucha węglowego (np. Ω-3 oznacza, że ostatnie wiązanie podwójne znajduje się przy trzecim od końca atomie węgla).
CH3 - (CH2)7 - CH=CH - (CH2)7COOH
kwas linolowy 18C
kwas α-linolenowy 18C
kwas γ-linolenowy 18C
kwas arachidonowy 20C
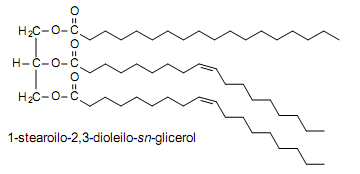
• Acyloglicerole budowa i właściwości

Monoacyloglicerole i diacyloglicerole posiadają wolne grupy hydroksylowe o charakterze polarnym, mają zdolność tworzenia miceli.
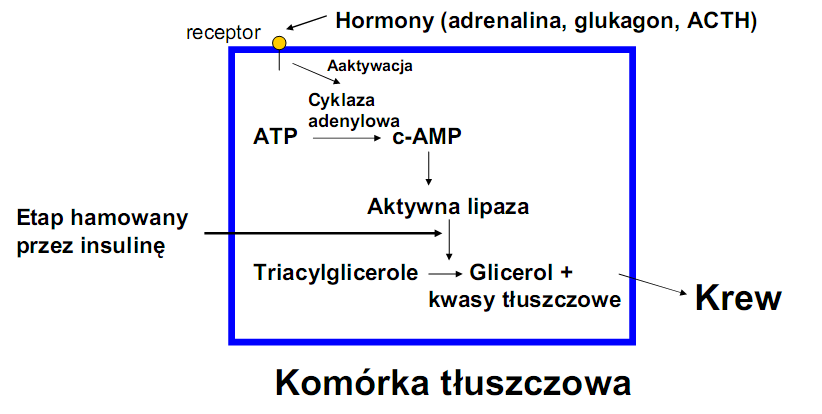
• Rozpad triacylogliceroli w komórce - lipoliza :
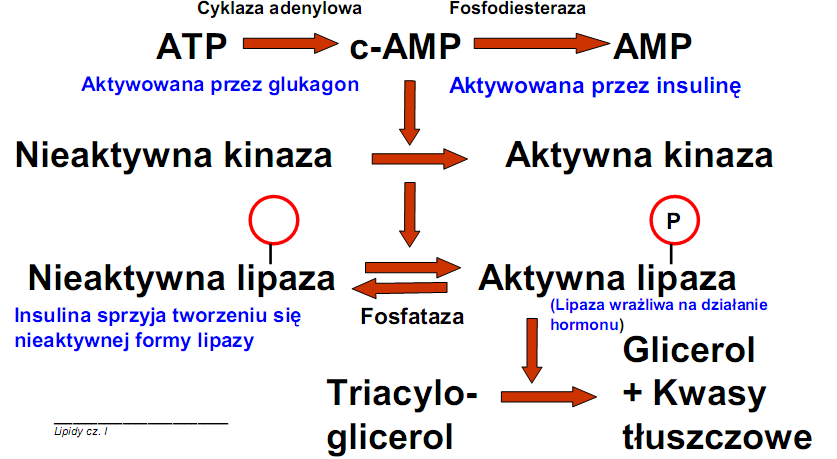
2. Rozpad kwasów tłuszczowych
• Szlak metaboliczny utleniania
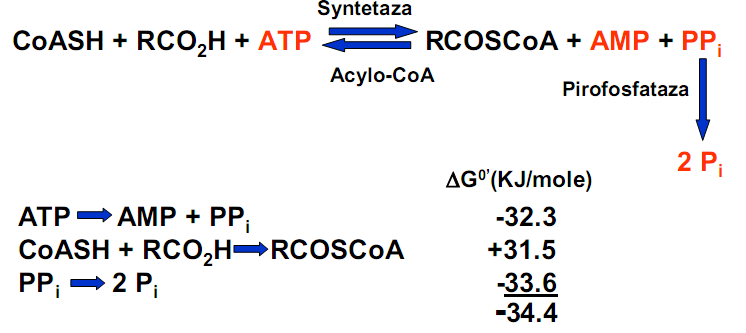
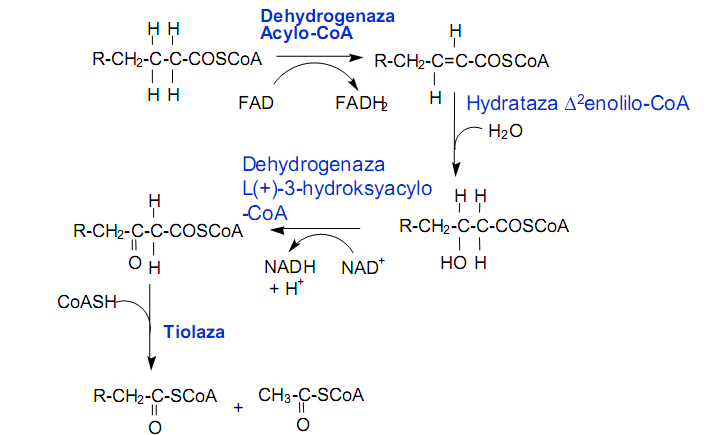
• Bilans energetyczny - palmitynian = 16 atomów węgla →
7 rund * 8 acetylo-CoA+7 FADH2 + 7 NADH + 7 H+
1 reszta acetylo-CoA = 12 ATP
NADH+ = 3 ATP
FADH2 = 2 ATP
brutto = 7*2 + 7*3 + 12*8 = 131 ATP
zapoczątkowanie procesu = 2 ATP
netto = 129 ATP
Nieparzystowęglowe kw. tłuszczowe dają w końcowej reakcji związek który ma 3 atomy węgla.
Powstają więc z niego cząsteczki acetylo-CoA i jedna cząsteczka propionylo-CoA (3C) :
1) β -oksydacja z utworzeniem acetylo-CoA
2) Pozostał związek 3C przekształcany do propionylo-CoA
3) Propionylo-CoA jest następnie przekształcany do bursztynylo-CoA
• Zaburzenia utleniania kwasów tłuszczowych :
Wzmożone utlenianie kwasów tłuszczowych jest charakterystyczne dla stanu głodzenia i cukrzycy, co prowadzi do powstania ciał ketonowych w mitochondriach wątrobowych (ketogeneza). Podczas głodzenia szczawiooctan zamiast razem z acetylo-CoA wejśd do cyklu Krebsa, jest używany do glukoneogenezy. W tych warunkach z acetylo-CoA powstają ciała ketonowe :
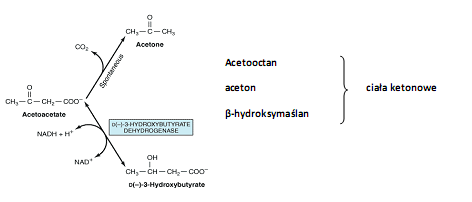
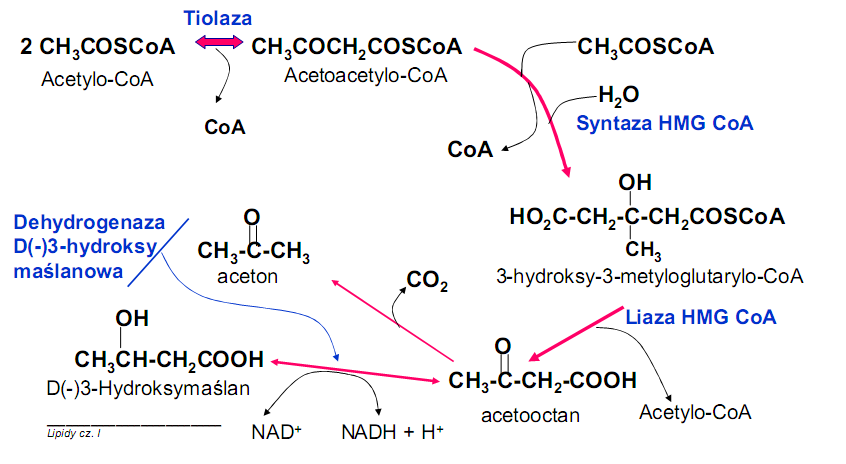
• Regulacja procesu
1) Pierwotna regulacja zależy od tkanki tłuszczowej i od tego ile FFA uwolnią do krwi z lipolizy TG
(FFA ---------> Acetylo-CoA -------- > ciała ketonowe)
Dlatego czynniki regulujące mobilizację FFA z tkanki tłuszczowej są ważne dla ketogenezy
2) Pierwsza przemiana FFA następuje pod wpływem CPT-I która reguluje wnikanie długołańcuchowych kwasów.
w stanie sytości większośd FFA (uwolnionych w niewielkiej ilości przez tk. Tłuszczową) ulega przekształceniu do acetylo-CoA i następnie estryfikacji do acylogliceroli i transportowane z wątroby w postaci VLDL
w stanie głodu tkanka tłuszczowa uwalnia dużo FFA, dużo acylo-CoA hamuje bezpośrednio karboksylaze Acetylo-CoA i nie powstaje inhibitor CPT I ( malonylo-CoA ). Dodatkowo w stanie głodu rośnie glukagon, który powoduje fosforylację karboksylazy acetylo-CoA a tym samym ją hamuje.
3) acetylo-CoA powstały w beta oksydacji może wejść do cyklu Krebsa lub w szlak ketogenezy
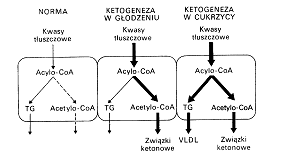
PATOLOGICZNE DZIAŁANIE CIAŁ KETONOWYCH
1) acetooctan jak i hydroksymaślan są doś mocnymi kwasami; gromadząc się w surowicy wywołują kwasicę metaboliczną
2) Wydalając się z moczem w postaci anionowej wiążą się z Na+ i K+ i tym samym zubożają organizm w sód i potas.
3) Kwasica metaboliczna prowadzi do zaburzeń w OUN, czego efektem jest śpiączka cukrzycowa tzw. śpiączka ketonowa
3. Biosynteza kwasów tłuszczowych:
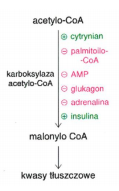
1) Początkowym etapem syntezy kwasu tłuszczowego jest wytworzenie
malonylo-CoA z acetylo-CoA przy udziale karboksylazy acetylo-CoA. Donorem CO2
jest HCO3
- dodatkowo do działania karboksylaza wymaga obecności biotyny (wit. H)
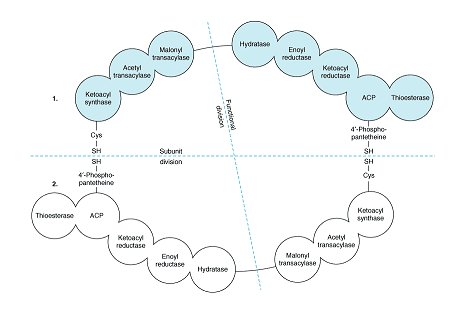
2) Malonylo-CoA jest dalej przekształcany przez „Kompleks Syntazy Kwasu
Tłuszczowego” Kompleks Syntazy jest dimerem, każda podjednostka posiada 7 aktywności
enzymatycznych w tym ACP. U niższych organizmów ACP = białko przenoszące acyl
pomiędzy podjednostkami całego kompleksu. U człowieka stanowi „miejsce przyczepu” dla malonylo-CoA).
- APC zawiera witaminę - kwas pantotenowy w formie fosfopanteteiny
APC jednej podjednostki łączy się przy pomocy wiązania FOSFOPANTETEINA-SH - HS-cysteina
z syntazą ketoacylową drugiej podjednostki (na zasadzie „głowa do ogona”)
a) Na początku inicjująca cząsteczka acetylo-CoA łączy się z grupą SH-cysteiny co jest katalizowane przez transacylazę acetylową
b) Malonylo-CoA łączy się z sąsiadującą grupą SH- fosfopanteteiny drugiego monomeru co jest katalizowane prez transacylazę malonylową i wytwarza się ACETYLO(ACYLO)MALONYLOENZYM
c) Grupa acetylowa (zaznaczona w kwadraciku) atakuje grupę metylenową reszty malonylowej w
reakcji katalizowanej przez syntezę 3-ketoacylową z uwolnieniem CO2.
d) To uwalnia grupę SH cysteiny. Powstała grupa Ketoacylowa zostaje następnie zredukowana
odwodniona i ponownie zredukowana, a następnie przeniesiona na wolne miejsce, które
zostało po Acetylo-CoA (w miejsce nr 1)
e) Powyższa sekwencja powtarza się 6 razy, za każdym włącza się nowa cząsteczka malonylo-CoA
aż do powstania 16 węglowego rodnika (palmitynowego)
f) Powstały 16 węglowy rodnik jest uwalniany z udziałem tioesterazy (też jest w kompleksie)
• Lokalizacja procesu w komórce
5. Cholesterol - biosynteza i funkcja w organizmie
a) Utworzenie mewalonianu
Wspomnieć należy, że ten właśnie etap podlega skomplikowanej regulacji zarówno naturalnej, jak i przy użyciu środków farmaceutycznych. Statyny - grupa leków obniżających poziom cholesterolu - kształtem cząsteczki przypominają substrat i prowadzą kompetycyjną inhibicję enzymu.[10]
b) Stworzenie fragmentu pięciowęglowego
c) Łączenie jednostek izoprenoidowych
d) Cyklizacja
e) Obróbka lanosterolu
Taka możliwość stanowi jedynie jedną z kilku. Nie ustalono bowiem dotychczas jednoznacznie, w jakiej kolejności zachodzą po sobie poszczególne przemiany.
Wyszukiwarka
Podobne podstrony:
EGZAMIN, far, II rok III sem, biochemia, egzamin
spr bioch ćw 2, far, II rok III sem, biochemia, lab
Egzamin z biochemii-, far, II rok III sem, biochemia, egzamin
Biochemia test 2010, studia-biologia, Licencjat, sem 3-4, biochemia
Sprawozdanie ćw 3, far, II rok III sem, biochemia, lab
sprawozdanie cw.8 do parafiny, far, II rok III sem, biochemia, lab
sem 8, biochemia
BIOCHEMIA, uczelnia - Licencjat, sem 1, biochemia
egzaminy III sem + biochem Dna, technologia żywności, biochemia, Nowy folder (2), biochemia testy
Zagadnienia dla BN, biotechnologia 2 sem rok2, pobrane z góry DS 7, II rok, Biochemia, Biochemia
SEM-15WF2011 - Metabolizm nukleotydow pur i pyr, Studia, I semestr II rok, Biochemia, Różne
sem 1 koło 1, BIOCHEMIA, AMINOKWASY
sem. zbiorcza 1 - pyt. z leku, Biochemia
Zerówka, Sem. III, Biochemia, Egzamin
wykłady z biochemii I sem
BIOCHEMIA WEJŚCIÓWKI SEM 2
BIOCHEMIA OŚ(1), biotechnologia 2 sem rok2, pobrane z góry DS 7, II rok, Biochemia, Biochemia
więcej podobnych podstron