WFIiS |
Imię i Nazwisko : Agata Jasiurkowska Kinga Poskard |
Rok: II |
Grupa: II |
Zespół: VIII |
Nr Ćwiczenia: 35 |
Pracownia Fizyczna
|
Temat : Elektroliza
|
||||
I Cel ćwiczenia:
Wyznaczanie równoważnika elektrochemicznego miedzi oraz stałej Faradaya w doświadczeniu z elektroliza wodnego roztworu ![]()
. Zapoznanie się ze sposobem precyzyjnego pomiaru masy na wadze analitycznej.
II Wstęp teoretyczny:
Charakterystyczną grupę przewodników prądu stanowią elektrolity - są to przeważnie wodne roztwory kwasów, zasad i soli, czyli substancji krystalicznych o wiązaniu jonowym. Przy rozpuszczaniu kryształu wiązania między jonami zostają zerwane i większa część atomów przechodzi do roztworu w postaci jonów, poruszających się bezładnie w roztworze.
dysocjacja elektrolityczna - rozpad na jony przy rozpuszczaniu,
elektrolit - otrzymany roztwór.
Zjawisko dysocjacji zachodzi np. w wodzie, alkoholu. Ze względu na bardzo dużą stałą dielektryczną wody (![]()
) stopień dysocjacji elektrolitycznej w roztworach wodnych jest znacznie większy.
Elektroliza - polega na wędrówce jonów do obojętnych chemicznie elektrod, zanurzonych w elektrolicie, po przyłożeniu do nich źródła prądu stałego o różnicy potencjałów V. Elektroda naładowana: ujemnie - katoda, dodatnio - anoda. Każda z elektrod przyciąga do siebie przeciwnie naładowane jony. Do katody dążą dodatnio naładowane kationy a do anody ujemnie naładowane aniony, oznacz to, że przez elektrolit płynie prąd. Po dotarciu do elektrod jony zostają zobojętnione i stają się zwykłymi atomami lub zgrupowaniami atomów (zamieniają się w obojętne elektrycznie związki chemiczne lub pierwiastki). Powstające w ten sposób substancje zwykle albo osadzają się na elektrodach lub wydzielają się z układu w postaci gazu.
Aby naładowany elektrycznie jon mógł zmienić się na elektrodzie na obojętny atom , musi przepłynąć ładunek równy ![]()
, gdzie e jest ładunkiem elementarnym elektronu , natomiast e wartościowością jonu:
n = 1 dla jonów typu Na+ , Cl - , H+
n = 2 dla jonów typu Cu2+ , SO42- , Ca2+ itd.
Liczba wydzielonych na elektrodzie atomów - stosunek wartości dostarczonego ładunku do ładunku pojedynczego jonu:
![]()
masa powstałych atomów - liczba atomów N pomnożona przez masę pojedynczego atomu równa stosunkowi masy gramoatomów A do liczby Avogadro NA
![]()
Wzór ten obejmuje dwa prawa elektrolizy Faradaya.
Masa m substancji wydzielonej na elektrodzie jest proporcjonalna do natężenia prądu I oraz czasu jego przepływu t (lub do ładunku Q).
![]()
lub ![]()
Z powyższych wzorów możemy obliczyć współczynnik proporcjonalności k (elektrochemiczny równoważnik substancji) i wynosi on:
![]()
Równoważniki elektrochemiczne k pierwiastków są proporcjonalne do ich równoważników chemicznych A/n. Iloczyn eNA wyraża ładunek potrzebny do wydzielenia jednego gramorównoważnika chemicznego substancji. Oznacza się go zwykle literą F i nazywa stałą Faradaya:
eNA = F = 96500 C
wartość ładunku elementarnego - stałą Faradaya podzielona przez liczbę Avogadro.
III Przedstawienie aparatury:
Elektrolizę siarczanu miedzi ![]()
przeprowadzamy w naczyniu z miedzianymi
elektrodami (katodą i dwoma anodami) w kształcie równoległych płyt, oddalonymi od siebie o kilka centymetrów (rys. 1). Natężenie przepływającego prądu ustawiamy na 0,55 A (amperomierz klasy: 0,5 i używany zakres: 0,75 A) . Pomiaru mas elektrod, wymagającego dużej precyzji, dokonujemy na wadze analitycznej (niepewność pomiaru na wadze: 0,001 g).
Czas elektrolizy (wynoszący 30 minut) mierzymy stoperem (my w naszych obliczeniach uwzględniamy niepewność pomiaru związaną z czasem, który zajęło ustawienie za pomocą opornicy suwakowej zadanej wartości natężenia prądu).
Rys. 1. Obwód elektryczny do przeprowadzania elektrolizy siarczanu miedzi.
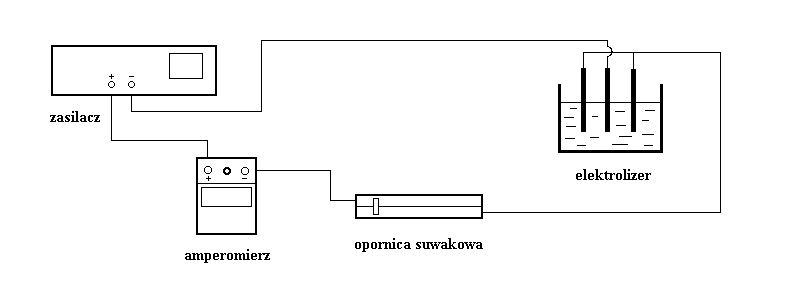
IV Przedstawienie wyników:
Elektrody (katodę i dwie anody) oczyściłyśmy papierem ściernym, wypłukałyśmy,
osuszyłyśmy suszarką i osobno zważyłyśmy na wadze analitycznej. Następnie połączyłyśmy obwód elektryczny zgodnie ze schematem na rysunku 1. Włączyłyśmy prąd i uruchomiłyśmy stoper. Elektrolizę przeprowadziłyśmy przy stałym natężeniu prądu (0,55 A). Elektrolizę przerwałyśmy po czasie około 30 minut, a następnie wyjęłyśmy, przemyłyśmy i osuszyłyśmy elektrody i znowu zważyłyśmy je na wadze analitycznej.
Tabela 1: Wyniki pomiaru masy katody i anod.
m1 [ g ] katoda (przed elektrolizą) |
m2 [ g ] anody (przed elektrolizą) |
M1 [ g ] katoda (po elektrolizie) |
M2 [ g ] anody (po elektrolizie) |
128,617 |
176,521 |
128,949 |
176,188 |
Klasa amperomierza: 0,5;
Używany zakres amperomierza: 0,75 [A];
Czas elektrolizy: 30 [min]=1800[s];
Natężenie prądu: 0,55[A].
V Opracowanie wyników:
Oznaczenia:
k - równoważnik elektrochemiczny miedzi,
m- masa miedzi wydzielona podczas elektrolizy,
![]()
- zmiana masy anody podczas elektrolizy,
![]()
- zmiana masy katody podczas elektrolizy,
![]()
- średnia zmiana masy anody i katody,
![]()
- masa katody przed elektrolizą,
![]()
- masa katody po elektrolizie,
![]()
- masa anody przed elektrolizą,
![]()
- masa anody po elektrolizie,
I- natężenie prądu,
t- czas trwanie elektrolizy,
F- stała Faradaya,
![]()
-masa molowa miedzi,
w- wartościowość jonów miedzi,
e- ładunek elementarny,
![]()
- liczba Avogadro.
Obliczamy masę m miedzi wydzielonej podczas elektrolizy na katodzie:
![]()
Obliczamy zmianę masy ![]()
anody i ![]()
katody podczas elektrolizy:
![]()
![]()
Obliczamy średnią zmianę masy ![]()
:
![]()
Korzystając z I prawa elektrolizy obliczamy wartość współczynnika elektrochemicznego miedzi:
![]()
Korzystając z otrzymanej wartości współczynnika k obliczamy stałą Faradaya F:
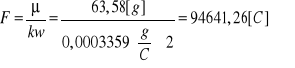
Posługując się wyznaczoną doświadczalnie stałą Faradaya obliczmy wielkość ładunku elementarnego:
![]()
Obliczenia niepewności pomiarowej:
Wartość niepewności pomiaru masy katody (na wielkość tej nie pewności może mieć wpływ przemywanie elektrod, zanieczyszczenie elektrolitu i niedokładne wysuszenie elektrod). Biorąc pod uwagę te czynniki masę osadzonej podczas elektrolizy miedzi podaję z dokładnością do dwóch miejsc znaczących:
m=0,33[g]
Niepewność pomiaru masy dla katody ( i anody) przyjmuję jako:
![]()
Niepewność pomiaru natężenia prądu:
![]()
Niepewność pomiaru czasu (związana m.in. z czasem, który zajęło ustawienie za pomocą opornicy suwakowej zadanej wartości natężenia prądu):
u(t)=70[s]
Niepewność wartości ładunku elektrycznego, który przepłynął przez elektrolit:
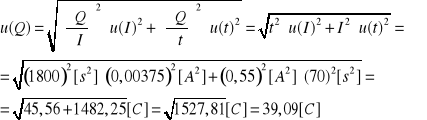
Niepewność otrzymanego doświadczalnie równoważnika elektrochemicznego miedzi: 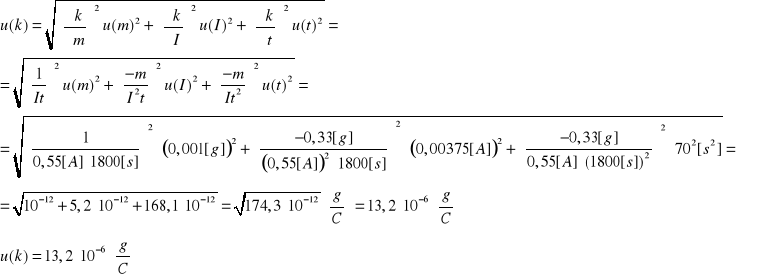
Niepewność wyznaczenia stałej Faradaya:
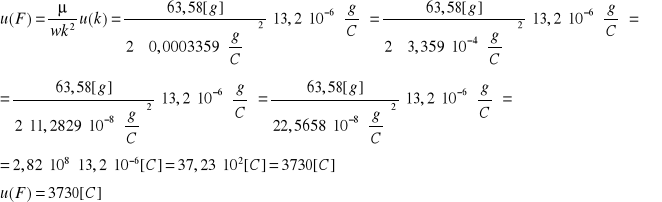
Niepewność wyznaczenia ładunku elementarnego:
![]()
Uzyskane wyniki zestawione w tabeli:
|
wartość tablicowa |
wartość wyznaczona w eksperymencie |
różnica |
niepewność
|
niepewność względna [%] |
|
0,3294 |
0,3359 |
0,0065 |
0,0132 |
3,93 |
|
96500 |
|
1858 |
3730 |
3,94 |
|
|
|
|
|
3,95 |
VI Wnioski:
Wyniki pomiarów masy pokazują, że na katodzie wydzieliło się o 0,001g miedzi mniej niż wynosi ubytek na obydwu anodach. Jest to wielkość równa granicy niepewności. Wnioskujemy, że można na podstawie tych wyników sformułować prawo zachowania masy (zmiana masy anod = zmiana masy katody) .
Niepewność pomiaru równoważnika elektrochemicznego miedzi wynosi: u(k)=![]()
i mieści się pięć razy w różnicy między wartością tablicową, a wartością wyznaczoną w eksperymencie(k=5), co jest prawdopodobnie związane z czasem, który zajęło ustawienie za pomocą opornicy suwakowej zadanej wartości natężenia prądu
( u(t)=70[s]). Różnica między wartością stałej Faradaya przez nas wyznaczoną, a wartością tablicową wynosi: 1858 [C] i mieści się w granicach niepewności wynoszącej: ![]()
. Różnica między wartością ładunku elementarnego przez nas wyznaczoną, a wartością tablicową wynosi: ![]()
i mieści się w granicach niepewności wynoszącej: ![]()
.
Z powyższego wynika, że wielkości te zostały wyznaczone dość dokładnie, ponieważ różnice między wartościami tablicowymi, a wyznaczonymi przez nas są niewielkie tzn. mieszczą się w granicach błędu.
Niepewności pomiarowe mogą być spowodowane przede wszystkim niedokładnością pomiaru czasu, a także niedokładnym osuszeniem elektrod, płukaniem (które mogło spowodować ubytek masy miedzi osadzonej na katodzie) lub też nie utrzymywaniem się cały czas stałego natężenia prądu (było ono kilkakrotnie kontrolowane i korygowane przez nas podczas trwania eksperymentu).
![]()
Wyszukiwarka
Podobne podstrony:
Cwiczenie 035, AGH, GiG, AGH, fizyka, laborki
Fizyka - Laborki (cwiczenie 0) opracowanie dc, AGH, GiG, AGH, fizyka, laborki
spraw.32.magdy, AGH, GiG, AGH, fizyka, laborki, Ćw.32
Lab 71, AGH, Fizyka, laborki
Przykładowe, AGH, Fizyka, laborki
W-optyka falowa, AGH, Fizyka, laborki
POPRAWA, MIBM WIP PW, fizyka 2, laborki fiza(2), 24-Wyznaczanie długości fali światła za pomocą siat
poprawakk1, MIBM WIP PW, fizyka 2, laborki fiza(2), 50-Charakterystyka licznika Geigera-Mullera i ba
Nr ćwiczenia5 moje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Sprawozdanie 000(po poprawie), AGH, i, Laborki, Laborki, Ćwiczenie 000
Cwiczenie09 wyniki, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Cwiczenie 3 - sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratoriu
Cwiczenie11 wyniki, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
cwiczenie 12, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, la
Cwiczenie 051, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, F
Nr ćwiczenia5 moje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Sprawozdanie 000(po poprawie), AGH, i, Laborki, Laborki, Ćwiczenie 000
więcej podobnych podstron