Fluorowce
1. Podaj skróconą konfigurację elektronową fluorowców, zaznaczając elektrony walencyjne i podając konfiguracje elektronowe ich prostych jonów.
2. Podaj skład jądra atomowego izotopu chloru - 35 i podaj liczby kwantowe opisujące elektrony walencyjne chloru.
3 Pierwiastki grupy 17. uszereguj od najbardziej do najmniej aktywnego. Zaproponuj doświadczalny sposób potwierdzenia poprawności takiego uporządkowania. Zapisz równania reakcji.
4. Do celów laboratoryjnych chlor można otrzymać działając w podwyższonej temperaturze kwasem solnym na tlenek manganu (IV). Produktami tej reakcji oprócz chloru są clorek manganu (II) i woda. Napisz równanie reakcji chemicznej, uzgodnij je metodą bilansu elektronowego i oblicz jaką objętość w warunkach normalnych zajmie chlor jeżeli w reakcji użyto 50 cm3 20% kwasu o gęstości 1,1g/cm3, przy założeniu, że reakcja przebiegała ze 100% wydajnością.
5. Chlor reaguje z wieloma pierwiastkami, między innymi z sodem, który spalany w chlorze tworzy chlorek sodu. Napisz konfigurację elektronową jonów chloru i sodu, oraz wykorzystując ich elektroujemność wyjaśnij jaki rodzaj wiązania występuje w tym związku.
6. Oblicz gęstość gazowego chloru w warunkach normalnych.
7. Gazowy chlor można otrzymać w reakcji roztworu kwasu solnego z manganianem(VII) potasu. Oblicz, ile decymetrów sześciennych chloru powstanie (warunki normalne), jeżeli do reakcji użyje się 50 cm3 roztworu kwasu solnego o stężeniu 38% i gęstości d = 1,2 g • cm-3.
8. Ułóż równanie reakcji otrzymywania chlorowodoru z chlorku sodu oraz kwasu siarkowego(VI).
9. Oblicz rozpuszczalność chlorowodoru, wiedząc, że w pewnych warunkach w 1 objętości wody rozpuszcza się 450 objętości tego gazu.
10.Oblicz, w jakim stosunku wagowym należy zmieszać bromek magnezu z chlorem, aby otrzymać 1,6 g bromu w warunkach normalnych. Załóż wydajność reakcji 100%.
11. Wyjaśnij, dlaczego wodne roztwory chloru i bromu (tzw. woda chlorowa i woda bromowa) mają odczyn kwasowy. Zapisz równania reakcji.
12. Porównaj rozpuszczalność chloru i bromu w wodzie, wiedząc, że w temperaturze 20°C tworzą one roztwory nasycone:
a) w 1 objętości wody - 2,3 objętości chloru, dCl2 = 3,2 g • dm-3, b) w 1 dm3 wody - 35 g bromu.
13. Chlorowodór bardzo dobrze rozpuszcza się w wodzie. W 1 objętości wody o temperaturze 20°C rozpuszcza się 450 objętości HO. Oblicz stężenie procentowe takiego roztworu.
14. Chlor rozpuszcza się w wodzie i powstaje tzw. woda chlorowa, która w większych stężeniach rozkłada się z wydzieleniem chlorowodoru. Zapisz równania zachodzących reakcji i określ odczyn roztworu.
15. Zapalona świeca umieszczona w zlewce z chlorem pali się kopcącym płomieniem. Wyjaśnij to zjawisko.
16. Odpowiedz, jak w grupie 1 7. zmienia się moc kwasów tlenowych, a jak beztlenowych.
17. Chlor tworzy cztery rodzaje kwasów tlenowych. Opisz strzałki, używając określeń: zwiększenie właściwości utleniających, wzrost mocy kwasu. HCIO HCIO2 HCIO3 HCIO4
18. Zapisz równania reakcji dla podanych substratów. Jeżeli reakcja nie zachodzi, wyjaśnij, dlaczego.
a) CI2 + HF b) CI2 + HBr c) CI2 + HI d) HCI+ F2
19. W wyniku nasycenia roztworu zasady sodowej chlorem powstaje mieszanina złożona z chlorku i chloranu(l) sodu. Zapisz wzory jonów, które istnieją w roztworze wodnym.
20 Do bielenia celulozy i włókien syntetycznych używa się m.in. chloranu(lll) sodu. Na skalę przemysłową chloran(lll) sodu otrzymuje się w reakcji nadtlenku wodoru z wodorotlenkiem sodu i tlenkiem chloru(IV) zmieszanych w stosunku wagowym 1 : 2 : 2. Oblicz stężenie procentowe chloranu(III) sodu otrzymanego ze zmieszania składników w stosunku molowym 2:2:2, przyjmując, że wydajność reakcji wynosi 100%, a wydzielający się tlen zebrano w osobnym naczyniu.
21. Pierwiastki: K, Al, Sn, Cd, Sb, As, Hg, Ag poddano działaniu m.in. roztworu kwasu solnego. Zapisz równania reakcji lub zaznacz, że reakcja nie zachodzi.
22. W wodzie rozpuszczono następujące tlenki chloru: Cl2O, ClO2, Cl2O6, Cl2O7. Zapisz wzory jonów obecnych w roztworze i wskaż te, których było najwięcej.
23 Chloran(V) potasu poddano rozkładowi termicznemu. Po zakończeniu reakcji produkt przemyto wodą, a osad odsączono. Do przesączu dodano roztworu AgNO3. Zapisz równania reakcji ilustrujące opisane procesy.
24. Fluorowodór jest kwasem średniej mocy (a = 22%). Oblicz stężenie niezdysocjowanych cząsteczek kwasu, jeżeli jego stężenie wyjściowe wynosiło 0,3 mol • dm-3.
25 W ilościach stechiometrycznych zmieszano roztwory wodne substancji: HCI, KBr, KBrO3. Podaj odczyn produktu
26. W dwóch probówkach znajdują się roztwory chlorku sodu i chlorku glinu. Opisz dwie różne metody identyfikacji tych soli. Uzasadnij swoje propozycje pisząc odpowiednie równania reakcji lub zaznaczając, że reakcja nie zachodzi.
27. Oblicz zawartość procentową czystego chlorku sodu w próbce, jeżeli rozpuszczono w wodzie 0,9 g badanej substancji, a następnie dodano nadmiar roztworu AgNO3, aż do całkowitego wytrącenia osadu. Po wysuszeniu ważył on 1,96 g.
28. Chlor w pewnych warunkach tworzy tlenki, w których występuje na I, III, IV, VI, VIII stopniu utlenienia. Napisz wzory tych tlenków i określ ich charakter chemiczny. Napisz równania reakcji tlenku chloru (III) i tlenku chloru (VII) z zasadą sodową. Podaj nazwy tych soli.
29. Przeprowadzono następujące doświadczenie. Do trzech probówek zawierających roztwory KF, KBr, KI dodano wodę chlorową ( Cl2). Za pomocą równań reakcji przedstaw przemiany zachodzące w poszczególnych probówkach lub zaznacz, że reakcja nie zachodzi. Sformułuj wniosek, który wynika z tego doświadczenia.
30. Jaki rodzaj wiązania występuje wewnątrz cząsteczki fluorowodoru, a jaki między cząsteczkami. Dlaczego HF w normalnych warunkach jest cieczą, a pozostałe wodorki fluorowców są gazami.
31. Oblicz masę atomową bromu zbudowanego z trzech izotopów: brom-80 (82%), brom-78 (9%) i z izotopu zawierającego 47 neutronów w jądrze.
32. Przy wprowadzaniu gazowego chloru do wody, powstaje roztwór zwany wodą chlorową. Podczas tej reakcji chlor ulega zarówno utlenieniu, jak i redukcji. Woda chlorowa ma właściwości utleniające - np. stosowana jest do dezynfekcji wody lub jako wybielacz do tkanin.
a) zapisz równanie reakcji wody z chlorem
b) przedstaw za pomocą równania reakcji chemicznej z tlenkiem manganu (IV) w obecności zasady potasowej, utleniające właściwości wody chlorowej.
33. Jod - 131 ulega przemianie B- z okresem połowicznego rozpadu 8 dni. Do tarczycy pacjenta wprowadzono 4 mole jodu - 131.
a) napisz równanie rozpadu jodu - 131
b) narysuj wykres obrazujący zmiany ilości jodu - 131 w tarczycy w ciągu 32 dni i odczytaj z niego ile jodu pozostanie po 12 dniach.
34. Podaj stopień utlenienia chloru w poniższych związkach:
Związek |
KClO4 |
CaCl2 |
HClO |
Ca(ClO3)2 |
ClO2 |
Stopień utlenienia chloru |
|
|
|
|
|
35. W pracowni znajduje się 35% roztwór kwasu solnego o gęstości 1,17g/cm3. Ile cm3 tego kwasu należy odmierzyć aby przygotować 250 cm3 0,2 molowego roztworu HCl. Przedstaw kolejność działań jakie przeprowadzisz przygotowując ten roztwór.
36. Czy wytrąci się osad chlorku srebra, jeżeli do 40 cm3 0,3 molowego roztworu kwasu solnego wprowadzimy 30 cm3 0,5 molowego roztworu azotanu (V) srebra. Iloczyn rozp. AgCl = 1,6 * 10-10.
37. W celu zbadania zawartości kwasu solnego w żołądku próbkę soku o objętości 10 cm3 miareczkowano 0,05 molowym roztworem zasady sodowej zużywając 20 cm3 tego roztworu. Oblicz stężenie kwasu solnego w próbce.
38. Oblicz masę chlorku strontu potrzebną do otrzymania 200 g nasyconego roztworu, jeśli rozpuszczalność soli w warunkach doświadczenia jest równa 70 g/100 g wody.
39. Oblicz masę soli zawartą w 300 g roztworu KI nasyconego w temperaturze 300 K, jeśli rozpuszczalność soli w tej temperaturze wynosi 140 g/100 g wody.
40. Oblicz stałą dysocjacji kwasu chlorowego(l), którego pH w 0,01-molowym roztworze wynosi 3
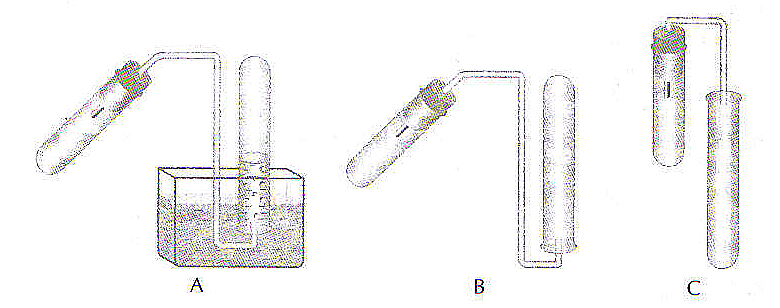
41. Przedstaw, który z podanych niżej schematów należy zbudować, aby otrzymać chlorowodór w reakcji chlorku sodu z kwasem siarkowym (VI)
Wyszukiwarka
Podobne podstrony:
chemia zadania 2 id 113035 Nieznany
Chemia zadania D
Chemia zadania 1
Chemia zadania, doświadczenia
alkohole - zadania, Matura, Chemia, zadania z organicznej
powtórka 2 zadania, Chemia zadania
zbior zadan z chemmiii, chemia, zadania
mol stechiometria, AdrianM, LO, CHEMIA, ZADANIA
Polimery fluorowe, Chemia, Prace, Prace
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
Chemia Zadania pH
Chemia zadania 5
zadania dodatkowe - dyfuzja i gestość, chemia, zadania dodatkowe
zadania dodatkowe - wiazania i izotopy, chemia, zadania dodatkowe
zadania dodatkowe - wzory, chemia, zadania dodatkowe
zadania na cp, chemia-zadania
więcej podobnych podstron