Sprawozdanie z ćwiczenia nr 3 / 6 marca 2008
Hanna Puzio
Karolina Sorbian
Agnieszka Radomska
Grupa 2b
Zespół 2
Temat: Kinetyka reakcji enzymatycznych.
1.Wstęp:
Kinetyka enzymów opisuje mechanizmy wiązania substratów przez enzymy oraz ich przekształcania w produkty. Dane wykorzystywane do analizy kinetycznej pochodzą z reakcji enzymatycznych przeprowadzonych w kontrolowanych warunkach umożliwiających śledzenie zmieniających się parametrów w czasie.
Enzymy jak wszystkie katalizatory, obniżają energię aktywacji (Ea lub ΔG‡) reakcji chemicznej, przyspieszając w ten sposób przebieg reakcji.
Przedmiotem ćwiczenia jest potwierdzenie słuszności równania Briggsa-Haldene'a które zakłada, że w przypadku katalizy za pomocą enzymów kinetyka rozkładu nadtlenku wodoru zależy od stosunku stężenia enzymu, stężenia substratu i temperatury. Celem jest również wyznaczenie wartości liczbowych stałych: Vmax i Km.
2.Tabele wyników i obliczenia:
Czas reakcji, min |
Liczba cm3 0,02 mol/dm3 roztworu KMnO4 |
Stężenie roztworu H2O2 [S], mol/dm3 |
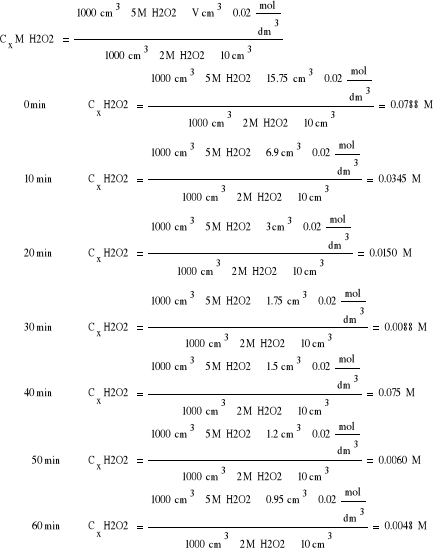
0 |
15,75 |
0,0788 |
10 |
6,9 |
0,0345 |
20 |
3 |
0,015 |
30 |
1,75 |
0,0088 |
40 |
1,5 |
0,075 |
50 |
1,2 |
0,006 |
60 |
0,95 |
0,0048 |
Obliczanie stężenia molowego [S]:

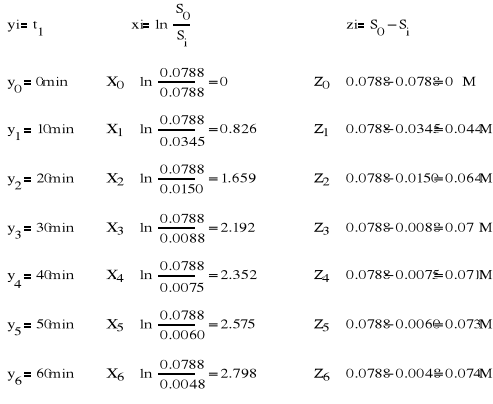
Obliczanie parametrów xi i zi:
Lp. |
xiyi [min] |
zi2 [M2] |
yizi [min·M] |
xizi [M] |
xi2 |
(xizi)2 [M2] |
1 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
2 |
0,8260 |
0,0019 |
0,4400 |
0,0036 |
0,0068 |
0,0000 |
3 |
33,1800 |
0,0041 |
1,2800 |
0,1062 |
2,7523 |
0,0113 |
4 |
65,7600 |
0,0049 |
2,1000 |
0,1534 |
4,8049 |
0,0235 |
5 |
94,0800 |
0,0050 |
2,8400 |
0,1670 |
5,5319 |
0,0279 |
6 |
128,7500 |
0,0053 |
3,6500 |
0,1880 |
6,6306 |
0,0353 |
7 |
167,8800 |
0,0055 |
4,4400 |
0,2071 |
7,8288 |
0,0429 |
|
|
|
|
|
|
|
Suma |
490,4760 |
0,0268 |
14,7500 |
0,8253 |
27,5553 |
0,1409 |
Na podstawie powyższej tabeli, obliczanie parametrów a i b:
Obliczanie wartości stałych występujących w równaniu Briggsa-Haldene'a:
3. Wnioski:
Wysycanie enzymu substratem (zbliżanie się do szybkości maksymalnej) oznacza, że maleje liczba wolnych cząsteczek enzymu, gdyż rośnie ilość tych związanych w kompleksie z substratem (ES). Co można było zauważyć zmniejszającym się stężeniem nadtlenku wodoru (przy stałej temperaturze) wraz z upływem czasu.

Wyszukiwarka
Podobne podstrony:
Sprawozdanie ćwiczenia nr 14damiana, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia
SPRAWOZDANIE Z CWICZENIA NR 4, Technologia zywnosci, semestr III, chemia zywnosci
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
Sprawozdania z fizycznej 1, Refraktometria - nasze, Sprawozdanie z ćwiczenia nr
SPRAWOZDANIE Z CWICZENIA NR 2, Technologia zywnosci, semestr III, chemia zywnosci
SPRAWOZDANIE Z CWICZENIA NR 6, Technologia zywnosci, semestr III, chemia zywnosci
wzor-sprawozdania-cwiczenia-nr-4-analiza-tworzyw, Chemia
SPRAWOZDANIE Z ĆWICZENIA NR 2, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania
SPRAWOZDANIE Z CWICZENIA NR 5, Technologia zywnosci, semestr III, chemia zywnosci
SPRAWOZDANIE Z CWICZENIA NR 1, Technologia zywnosci, semestr III, chemia zywnosci
SPRAWOZDANIE Z CWICZENIA NR 3, Technologia zywnosci, semestr III, chemia zywnosci
SPRAWOZDZANIE Z ĆWICZENIA NR 6, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdani
SPRAWOZDANIE Z CWICZENIA NR 4, Technologia zywnosci, semestr III, chemia zywnosci
Sprawozdanie z ćwiczenia nr 2(transformator), Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pa
Sprawozdanie z cwiczenia nr 1 justa
Sprawozdanie z ćwiczenia nr 1
Sprawozdanie z cwiczenia nr 1
napiecie pow nr 2, Chemia fizyczna AGH laborki, lab 2
Sprawozdanie z cwiczenia nr 9, Część ćwiczeniowa:
więcej podobnych podstron