Zakład Chemii Fizycznej
Laboratorium Studenckie
SPRAWOZDANIE
ĆWICZENIE 26
ZALEŻNOŚĆ SEM OGNIWA OD TEMPERATURY
WYKONALI:
Roman Jędrzejewski
Emil Langiewicz
Technologia Chemiczna
rok III grupa II
SZCZECIN 2002r
WSTĘP TEORETYCZNY :
Siła elektromotoryczna ogniwa, SEM, różnica potencjałów dwóch półogniw, otwartego ogniwa elektrochemicznego (przez ogniwo nie płynie prąd, znajduje się ono w stanie równowagi). Źródłem SEM są reakcje przebiegające w półogniwach (ich suma nosi nazwę reakcji ogniwa). SEM zależy od aktywności jonowej składników półogniw, temperatury i ciśnienia. Może być wyliczona z równania Nernsta:
gdzie: E0 - standardowa SEM ogniwa równa różnicy potencjałów standardowych półogniwa prawego i lewego, R - stała gazowa, T - temperatura bezwzględna, n - liczba elektronów wymienianych podczas jednego stechiometrycznego przebiegu reakcji ogniwa, F - stała Faradaya (elektroliza), aL, aM - aktywności produktów, aA, aB aktywności substratów, l, m, a, b - wykładniki potęgowe równe współczynnikom stechiometrycznym w równaniu reakcji ogniwa. Znak SEM jest dodatni, gdy zapis reakcji ogniwa (a więc i schematu ogniwa) odpowiada jej samorzutnemu przebiegowi.
Leclanchégo suche ogniwo, ogniwa galwaniczne stosowane powszechnie jako nieładowalne źródło energii elektrycznej (nie może być ponownie ładowane jak akumulator).Składa się z pręta węglowego (anoda) otoczonego mieszaniną sproszkowanego węgla i dwutlenku manganu (braunsztyn), umieszczonego w porowatym pojemniku, który znajduje się w szklanym naczyniu zawierającym elektrolit (roztwór chlorku amonu) oraz cynkową katodę. W nowych rozwiązaniach jako elektrolit stosuje się pastę skrobiową. Podczas pracy suchego ogniwa Leclanchégo cynk utlenia się do jonów Zn2+, zaś MnO2 ulega redukcji do chlorku manganu(II). Suche ogniwa Leclanchégo łączone szeregowo po trzy, to popularne "baterie płaskie" o symbolu 3R12 (ich siła elektromotoryczna wynosi ok. 4,5 V), pojedyncze suche ogniwo Leclanchégo, o napięciu ok. 1,5 V, produkowane najczęściej w kształcie walca, zależnie od jego średnicy, stanowią popularne "baterie okrągłe", np. R6 (tzw. "paluszki"), R10, R14, R20.
Ogniwo elektrochemiczne, ogniwo galwaniczne, system służący do zamiany energii procesów elektrochemicznych na energię elektryczną.Ogniwo elektrochemiczne składa się z dwóch układów redoks wraz z zanurzonymi w nich elektrodami (są to tzw. półogniwa) oraz drutu łączącego elektrody. Układy te mogą znajdować się w tym samym roztworze (wówczas zanurzone są w nim dwie różne elektrody) lub w różnych roztworach, przedzielonych przegrodą albo połączonych kluczem elektrolitycznym. Do najbardziej popularnych w laboratorium ogniw elektrochemicznych należą: ogniwo elektrochemiczne Daniella (-)Zn ⊥ ZnSO4 ş CuSO4 ⊥ Cu(+) (kreska ⊥ oznacza granicę faz, znak ş jest symbolem klucza elektrolitycznego) i ogniwo elektrochemiczne Westona (tzw. ogniwo normalne) (-)Cd(Hg) ⊥ CdSO4,H2O ⊥ Hg2SO4,Hg(+), które stanowi wzorzec SEM.
Rozróżnia się ogniwa elektrochemiczne:
1) tworzenia (chemiczne) - w ogniwie zachodzi reakcja tworzenia związku chemicznego (np. w ogniwie elektrochemicznym (+) Pt, H2 ⊥ HCl ⊥ Cl2, Pt(-) powstaje HCl),
2) stężeniowe - zbudowane z dwóch jednakowych półogniw różniących się tylko stężeniami reagentów,
3) amalgamatowe - tworzywem elektrod są dwa różne amalgamaty.
Akumulator elektryczny, ogniwo elektrochemiczne tak skonstruowane, aby reakcje redoks przebiegały w nim w sposób odwracalny, dzięki czemu zużycie składników akumulatora (elektrolitu, elektrod) podczas czerpania energii (cykl rozładowania akumulatora) może być cofnięte wskutek elektrolizy (cykl ładowania akumulatora), kosztem energii z zewnątrz.Ze względu na stosowany elektrolit wyróżnia się akumulatory kwasowe (np. akumulator ołowiowy o schemacie Pb, PbSO4 ⊥ H2SO4 ⊥ PbO2, Pb, w którym przebiega reakcja PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O) oraz zasadowe (np. akumulator żelazowo-niklowy o schemacie Fe, Fe(OH)2 ⊥ KOH ⊥ Ni(OH)2, Ni(OH)3, Ni, w którym przebiega reakcja Fe + 2Ni(OH)3 = Fe(OH)2 + 2Ni(OH)2). Najważniejsze parametry akumulatora to SEM i pojemność, definiowana jako całkowity ładunek elektryczny, który można uzyskać z akumulatora naładowanego aż do jego niemal zupełnego rozładowania. Obecnie używa się nowszych, lżejszych i trwalszych typów, takich jak np. akumulator srebrowo-cynkowy. Akumulatory najnowszej generacji zawierają jony litu.
Anoda, elektroda przyjmująca elektrony. W elektrolizerze i w lampach elektronowych anoda jest elektrodą dodatnią, w ogniwie galwanicznym i akumulatorach elektrycznych - ujemną. W procesie elektrolizy na anodzie zachodzą procesy utleniania.
Katoda, w elektrotechnice i elektronice elektroda połączona z ujemnym biegunem źródła prądu (tj. znajdująca się na niższym potencjale niż druga elektroda - anoda). W elektrochemii elektroda na której zachodzą procesy redukcji. W ogniwach elektrochemicznych katoda jest przeciwnie elektrodą dodatnią
Ogniwo termoelektryczne, czujnik temperaturowy działający na zasadzie zjawiska Peltiera i Thomsona. Składa się z dwóch cienkich drucików metalowych (termoelektrod), różniących się potencjałami termoelektrycznymi, zespawanych lub zlutowanych ze sobą na jednym końcu, zaizolowanych elektrycznie i umieszczonych w obudowie.Siła termoelektryczna pojawiająca się na termoelektrodach jest funkcją różnicy temperatur miejsca spojenia drucików, tj. spoiny pomiarowej, i wolnych (zimnych) końców drucików. Wykres tej funkcji nosi nazwę charakterystyki termometrycznej termopara. Siłę termoelektryczną mierzy się za pomocą miliwoltomierzy lub kompensatorów. Termopary mogą być łączone szeregowo w tzw. termostosy, co powoduje zwiększenie wartości siły termoelektrycznej. Przykładowy skład termoelektrod: (+) stop platyny z rodem (-) platyna, (+) chromel (stop niklu z chromem) (-) alumel (stop zawierający nikiel, aluminium, krzem i mangan).
Półogniwo, półogniwo elektrochemiczne, układ składający się z co najmniej dwóch faz, które mają kontakt i mogą wymieniać jony. Najczęściej stosowane typy półogniw:
1) półogniwa odwracalne względem kationu:
a) półogniwa z aktywną elektrodą metalową, np. blaszka miedziana zanurzona w roztworze zawierającym jony Cu2+.
b) półogniwa gazowe, np. I elektroda wodorowa.
2) półogniwa odwracalne względem anionu:
a) półogniwa gazowe, np. elektroda platynowa zanurzona w roztworze chlorków i opłukiwana strumieniem gazowego chloru.
b) półogniwa drugiego rodzaju, np. chlorosrebrowe półogniwa.
3) półogniwa trzeciego rodzaju, np. Pb ⊥ PbC2O4, CaC2O4, Ca2+.
TEMPERATURA [ C] |
TEMPERATURA [ K ] |
SEM |
25 |
298,15 |
0,4432 |
30 |
303,15 |
0,4410 |
35 |
308,15 |
0,4383 |
40 |
313,15 |
0,4350 |
45 |
318,15 |
0,4310 |
1. W ogniwie chemicznym o budowie zachodzą następujące procesy:
na anodzie: 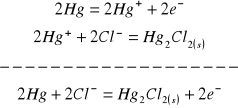
na katodzie: ![]()
co sumarycznie daje: ![]()
2. Używane w pomiarach ogniwo można przedstawić schematycznie w następujący sposób:
(-) ![]()
(+)
3. Równanie Nersta na SEM badanego ogniwa:
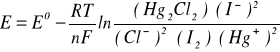
[V]
Ponieważ aktywność ciał stałych jest równa 1, więc (I2)=1 i (Hg2Cl2)=1. Wartość aktywności jonów Hg+ pomijam ze względu na bardzo małe stężenie.
Stąd:
![]()
[V]
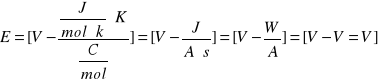
gdzie:
E- siła elektromotorczna [V]
E0 - normalna siła elektromotoryczna [v]
R - stała gazowa - 8,314 [J/mol.K]
T - temperatura bezwzględna [K]
n - liczba elektronów biorących udział w reakcji
F - stała Faradaya - 96485,3 C/mol
4. Dane literaturowe na temat potencjałów normalnych elektrod używanych w doświadczeniach:
Elektroda |
Reakcja elektrodowa |
Potencjał E0 [V] |
I-/I2,Pt |
I2+2e-= 2I- |
+0,5360 |
Cl-/Hg2Cl2,Hg |
2Hg ++2 Cl-= Hg2Cl2 |
+0,2680 |
5. Obliczenia normalnej siły elektromotorycznej ogniwa ( dla aktywności reagentów równych jedności) - ΔE0:
![]()
[V]
gdzie: E01 - potencjał normalny elektrody dodatniej [V]
E02 - potencjał normalny elektrody ujemnej [V]
ΔE0=0,5360-0,2420=0,2940 [V]
6. Obliczenie stosunku aktywności jonów I-/Cl- w ogniwie na podstawie zmierzonej wartości SEM ogniwa (napięcia ogniwa w warunkach bezprądowych) w warunkach standardowych i obliczonej wartości normalnej siły elektromotorycznej ogniwa:
Stosunek aktywności jonów I-/Cl- wyznaczam z równania Nersta na SEM badanego ogniwa
![]()
po przekształceniu:
![]()
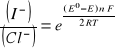
otrzymuje:
![]()
7. Wykres zależności E = f(T):
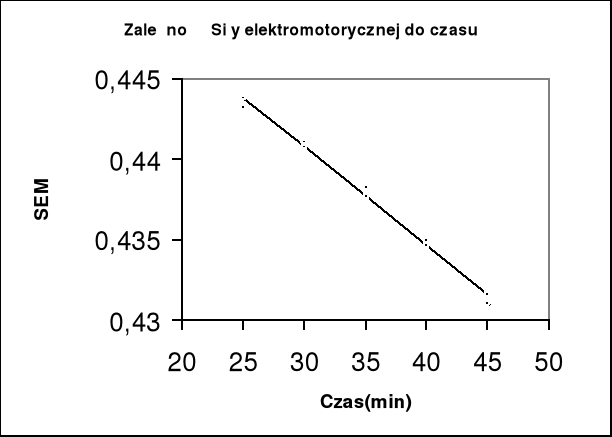
8. Wyznaczenie wartości współczynnika temperaturowego:
Współczynnik kierunkowy (a) prostej o równaniu ogólny y=ax+b
wynosi -0,00058 , czyli:
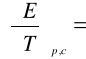
-0,00061 [V/K]
9. Ze wzoru Gibbsa-Helmholtza wyznaczamy wartości entalpii ΔH, entalpii swobodnej ΔG oraz entropii ΔS z jakimi przebiegała reakcja:
Dla T=298,15 [K]
E=0,4432 [V]
F=96485,3 [C/mol]
(dE/dT)p= -0,00061 [V/K]
z=2
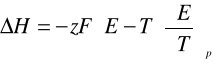
ΔH= -2 * 96485,3 *[ 0,4432 - 298,15 * (-0,00061)]= -50428,71744 [J/mol]
ΔH= - 50428,71744 [kJ/mol]
Dla T=298,15 [K]
E=0,4432 [V]
F=96485,3 [C/mol]
(dE/dT)p= -0,00061 [V/K]
z=2
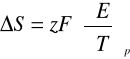
ΔS = 2 * 96485,3 * (-0,00061)= -117,7120066 [J/mol*K]
ΔS = -117,7120066 [J/mol*K]
Dla E=0,4432 [V]
F=96485,3 [C/mol]
z=2
![]()
ΔG = -2 * 96485,3 * 0,4432 = 85524,56992 [J/mol]
ΔG = -85524,56992 [J/mol]
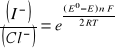
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE nr 15, Studia, Politechnika
SPRAWOZDANIE nr 21, Studia, Politechnika
SPRAWOZDANIE nr 18(2), Studia, Politechnika
SPRAWOZDANIE nr 26, Studia, Politechnika
SPRAWOZDANIE nr 18(1), Studia, Politechnika
SPRAWOZDANIE nr 15pop, Studia, Politechnika
SPRAWOZDANIE nr 23(1), Studia, Politechnika
SPRAWOZDANIE nr 10, Studia, Politechnika
SPRAWOZDANIE10, Studia, Politechnika
SPRAWOZDANIE nr 6, Studia, Politechnika
SPRAWO~1(10), Studia, Politechnika
Sprawozdanie 19 Ania ost2, Studia, Politechnika
chemia sciaga, Studia Politechnika Wydział Mechaniczny, studia, sem I, II, chemia sprawozdania
chemijaadf, Studia Politechnika Wydział Mechaniczny, studia, sem I, II, chemia sprawozdania
chemijaa, Studia Politechnika Wydział Mechaniczny, studia, sem I, II, chemia sprawozdania
Obróbka cieplna stopów nieżelaznych, Studia Politechnika Poznańska, Semestr III, OCiS, Sprawozdania
więcej podobnych podstron