Niemetale
klasa II g gr. 1
imię i nazwisko: ...............................................................................................................
Podaj nazwy systematyczne następujących związków: (4p)
a) Mg(NO3)2 .......................................... b) SO3 ............................................
c) H2SO3 ................................................ d) HCl(g) .........................................
Stężony kwas siarkowy(VI) jest roztworem około: (1p)
25%
36%
65%
96%
Chlor jest: (1p)
gazem bezbarwnym dymiącym na powietrzu
gazem brunatnym o ostrym zapachu
toksycznym, żółtozielonym gazem
gęstą, higroskopijną, bezbarwną cieczą
Podaj wzory sumaryczne następujących związków: (2p)
tlenek azotu(III) wzór: ...................................
amoniak wzór: ...................................
Podaj skróconą konfigurację podpowłokową siarki oraz na jej podstawie (2p)
określ ważniejsze jej stopnie utlenienia.
Podaj jakie odmiany alotropowe tworzy tlen. Czym się one różnią? (2p)
Zapisz równania reakcji w formie cząsteczkowej: (3p)
tlenku węgla(IV) z wodą
magnezu z kwasem solnym
azotu z wodorem
Wyjaśnij, jaka jest różnica właściwości chemicznych między stężonym (2p)
a rozcieńczonym kwasem azotowym(V) podczas reakcji kwasu z metalami.
Podaj po jednym zastosowaniu: (2p)
grafitu ..................................................................................................
kwasu azotowego(V) ...........................................................................
Zapisz równania reakcji przemian przedstawionych za pomocą (4p)
następującego schematu: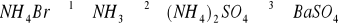
Reakcję 3 zapisz również w formie jonowej.
Zapisz równanie reakcji termicznego rozkładu manganianu(VII) potasu, (3p)
który rozkłada się na tlen cząsteczkowy, tlenek manganu(IV) i manganian(VI) potasu oraz oblicz objętość tlenu (warunki normalne) otrzymanego w wyniku
rozkładu 7,9 g manganianu(VII) potasu
Zaprojektuj doświadczenie (schematyczny rysunek, obserwacje, zapis (3p)
równania reakcji w formie cząsteczkowej i jonowej) służące do wykrycia
jonów Br-.
Niemetale
klasa II g gr. 2
imię i nazwisko: ...............................................................................................................
Podaj nazwy systematyczne następujących związków: (4p)
a) NO2 .............................................. b) HNO2 ..........................................
c) CaSO4 .......................................... d) HBr(g) ..........................................
Stężony kwas solny jest roztworem około: (1p)
96%
65%
36%
25%
Azot jest gazem: (1p)
bezbarwnym i nietoksycznym
bladoniebieskim, dobrze rozpuszczalnym w wodzie
zółtozielonym o ostrym zapachu
jasnożółtym, słabo rozpuszczalnym w wodzie
Podaj wzory sumaryczne następujących związków: (2p)
tlenek azotu(V) wzór: ...................................
siarkowodór wzór: ...................................
Podaj skróconą konfigurację podpowłokową węgla oraz na jej podstawie (2p)
określ ważniejsze jego stopnie utlenienia.
Podaj jakie odmiany alotropowe tworzy siarka. Czym się one różnią? (2p)
Zapisz równania reakcji: (3p)
tlenku siarki(VI) z wodą
cynku z kwasem solnym
chloru z wodorem
Wyjaśnij, jaka jest różnica właściwości chemicznych między stężonym (2p)
a rozcieńczonym kwasem siarkowym(VI) podczas reakcji kwasu z metalami.
Podaj po jednym zastosowaniu: (2p)
siarki ............................................................................................
amoniaku ......................................................................................
Zapisz równania reakcji przemian przedstawionych za pomocą (4p)
następującego schematu: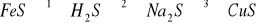
Reakcję 3 zapisz również w formie jonowej.
Zapisz równanie reakcji katalitycznego rozkładu nadtlenku wodoru, który (3p)
rozkłada się na wodę i tlen cząsteczkowy oraz oblicz objętość tlenu (warunki normalne) otrzymanego w wyniku rozkładu 13,6 g nadtlenku wodoru.
Zaprojektuj doświadczenie (schematyczny rysunek, obserwacje, zapis (3p)
równania reakcji w formie cząsteczkowej i jonowej) służące do wykrycia
jonów Cl-.
Wyszukiwarka
Podobne podstrony:
Odpowiedzi na test (A-F) z niemetali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
sprawko korozja niemet, chemia pwr
,chemia L,korozja materiałów niemetalicznych
KOROZJA MATERIAŁÓW NIEMETALICZNYCH, Studia, Sem 2, SEMESTR II, SEMESTR I, chemia budowlana
roszak,chemia L, korozja materiałów niemetalicznych
Prezentacja Chemia Niemetale
Chemia Bionie wyk1
Cechy niemetryczne czaszki
chemia powt
wyklad 11 toksyczno niemetali
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
więcej podobnych podstron