Celem ćwiczenia jest wyznaczenie granicznego przewodnictwa molowego.
Przewodnictwo elektryczne roztworu Г jest to odwrotność oporu stawianego przez roztwór elektrolitu.
Przewodnictwo elektryczne roztworu jest proporcjonalne do efektywnej powierzchni elektrody s oraz odwrotnie proporcjonalne do odległości między elektrodami l.
![]()
κ - przewodnictwo właściwe elektrolitu
k - stała naczynka
Ponieważ nie jest możliwe określenie efektywnej powierzchni elektrody stałą naczynka wyznacza się na podstawie pomiaru przewodnictwa roztworu wzorcowego
(zwykle roztwór KCl).
Przewodnictwo molowe λ jest to zdolność przewodzenia prądu przez roztwór zawierający 1 mol ładunków pomiędzy elektrodami.
![]()
c - stężenie molowe ładunków dowolnego znaku
Pomiarów przewodnictwa dokonuje się za pomocą konduktometru - zmodyfikowanego mostka Wheotstone`a.
Gęstość roztworu NaCl o stężeniu 0,05 mol/dm3 wyznaczam na podstawie pomocniczego wykresu zależności d = f(c).
Dane na podstawie których sporządziłem wykres zebrane są w poniższej tabeli:
c [mol/dm3] |
d [kg/m3] |
0,1720 |
1005,3 |
0,3464 |
1012,2 |
0,7026 |
1026,8 |
1,0688 |
1041,3 |
1,4451 |
1055,9 |
1,8317 |
1070,7 |
2,2288 |
1085,7 |
2,6367 |
1100,9 |
3,0553 |
1116,2 |
3,4855 |
1131,9 |
3,9272 |
1147,8 |
4,3808 |
1164 |
4,8465 |
1180,4 |
5,3251 |
1197,2 |
Wykres zależności d = f(c).
Wyznaczona na podstawie wykresu gęstość roztworu NaCl o stężeniu 0,05 mol/dm3 wynosi
dNaCl = 1003 g/dm3
Gęstości sporządzonych roztworów wyznaczyłem na podstawie pomocniczego wykresy zależności
d = f(m).
Dane na podstawie których sporządziłem wykres zebrane są w poniższej tabeli:
m [mol/kg] |
d [kg/m3] |
0,1720 |
1005,3 |
0,3465 |
1012,2 |
0,7028 |
1026,8 |
1,0691 |
1041,3 |
1,4454 |
1055,9 |
1,8321 |
1070,7 |
2,2294 |
1085,7 |
2,6374 |
1100,9 |
3,0560 |
1116,2 |
3,4863 |
1131,9 |
3,9281 |
1147,8 |
4,3819 |
1164 |
4,8476 |
1180,4 |
5,3264 |
1197,2 |
Wykres zależności d = f(m).
Wyniki doświadczenia zebrane są w tabelach:
Roztwór wzorcowy (KCl):
|
Г [mS] |
|||
c [mol/dm] |
1 |
2 |
3 |
średnia |
0,01 |
1,511 |
1,517 |
1,519 |
1,515667 |
Roztwory badane:
skład roztworu |
gęstość |
stężenie |
Г [mS] |
||||||
mNaCl 0,05mol/dm3 [g] |
mH2O [g] |
nNaCl [mol] |
d [g/cm3] |
m [mol/kg] |
c [mol/dm3] |
1 |
2 |
3 |
średnie |
1,22 |
23,02 |
0,608*10-4 |
1,0012 |
0,0026 |
0,0023 |
0,406 |
0,406 |
0,407 |
0,406 |
2,43 |
22,09 |
1,211*10-4 |
1,0013 |
0,0055 |
0,0042 |
0,684 |
0,695 |
0,701 |
0,693 |
4,80 |
19,79 |
2,393*10-4 |
1,0016 |
0,0121 |
0,0071 |
1,275 |
1,284 |
1,290 |
1,283 |
11,84 |
12,18 |
5,902*10-4 |
1,0029 |
0,0485 |
0,0127 |
2,88 |
2,89 |
2,89 |
2,89 |
|
|
|
|
|
0,0500 |
5,3 |
5,32 |
5,33 |
5,32 |
Na podstawie pomiarów dla roztworu wzorcowego wyznaczam stałą naczynka konduktometrycznego:
Przewodnictwo molowe roztworu KCl o stężeniu 0,01 mol/dm3 wynosi κ=141,3 mS m-1
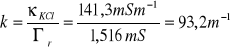
Wyznaczam przewodnictwa właściwe badanych roztworów.
Wyniki zebrane są w tabeli:
c [mol/dm3] |
Г [mS] |
κ [mS m-1] |
0,0023 |
0,406 |
37,8 |
0,0042 |
0,693 |
64,6 |
0,0071 |
1,283 |
119,6 |
0,0127 |
2,89 |
269,3 |
0,0500 |
5,32 |
495,8 |
Przykład obliczeń:
![]()
Wyznaczam przewodnictwa molowe badanych roztworów.
Wyniki zebrane są w tabeli:
c [mol/dm3] |
κ [mS m-1] |
λ [mS m2/mol] |
0,0023 |
37,8 |
16,45 |
0,0042 |
64,6 |
15,38 |
0,0071 |
119,6 |
16,84 |
0,0127 |
269,3 |
21,21 |
0,0500 |
495,8 |
9,92 |
Przykład obliczeń:
![]()
Wykres zależności ![]()
:
Wyznaczone przewodnictwo graniczne roztworu NaCl jest równe wyrazowi wolnemu równania zależności![]()
.
Odchylenie standardowe wyrazu wolnego wynosi Sb= 2,73
λo = 11![]()
3mS m2/mol
Tablicowa wartość granicznego przewodnictwa molowego roztworu NaCl wynosi
λot= 12,645 mS m2/mol
Wnioski:
Obliczona wartość zgadza się z wartością tablicową.
Duży błąd wynika z niedokładności sporządzenia roztworów.
Podczas sporządzania wykresu pominąłem jeden punkt gdyż odbiegał on znacznie od pozostałych.
c [mol/dm3]
d [g/dm3]
m [mol/kg]
d [g/dm3]
λ [mS m2/mol]
![]()
λ=79,355![]()
+ 11,326
R2=0,738
Wyszukiwarka
Podobne podstrony:
chemia fizyczna 21, CHEMIA FIZYCZNA SPRAWKA 4 SEM
OPRACOWANIE WYNIKÓW, CHEMIA FIZYCZNA SPRAWKA 4 SEM
Fizyczna strona główna czysta, CHEMIA FIZYCZNA SPRAWKA 4 SEM
91, CHEMIA FIZYCZNA SPRAWKA 4 SEM
204, CHEMIA FIZYCZNA SPRAWKA 4 SEM
fizyczna 99, CHEMIA FIZYCZNA SPRAWKA 4 SEM
91 fizyczna, CHEMIA FIZYCZNA SPRAWKA 4 SEM
sprawozdanie nr 27, CHEMIA FIZYCZNA SPRAWKA 4 SEM
fizyczna ćw. 23, CHEMIA FIZYCZNA SPRAWKA 4 SEM
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
28fizyczna, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyc
spr 8.5 obliczenia1, semestr 4, chemia fizyczna, sprawka laborki, 8.5
6, semestr 4, chemia fizyczna, sprawka laborki, 6.11
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
sekuła, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyczna,
fizyczna 2011 egzamin - teoria, technologia chemiczna, chemia fizyczna2010-2011, sem 4, fizyczna egz
więcej podobnych podstron