Anabolizm- procesy syntezy związków złożonych ze związków prostych, jak również synteza związków prostych. Są to reakcje endoergiczne. Do podstawowych reakcji anabolicznych zalicza się biosyntezę:
białek,
kwasów nukleinowych,
cukrów złożonych,
tłuszczów,
drobnocząsteczkowych związków chemicznych.
Aminokwasy- związki budujące białka, posiadające w swojej strukturze zarówno grupę aminową jak i karboksylową.
H3 + N - CH -COO-
R
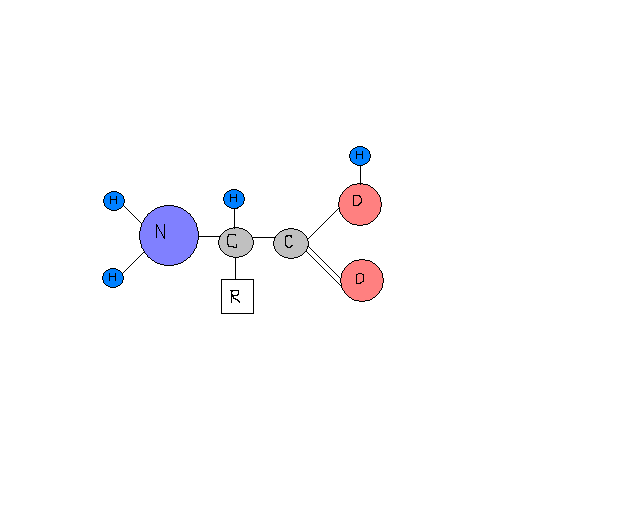
*alfa=α
Położenie grupy
aminowej względem
karboksylowej
α- aminokwasy
β- aminokwasy
itd........
PODZIAŁ AMNOKWASÓW
ze względu na:
AMINOKWASY MOŻNA PODZIELIĆ NA KILKA SPOSOBÓW
Ze względu na usytuowanie grupy -NH2 względem węgla w cząsteczce
* Aminokwasy α
* Aminokwasy β
* itd....
Ze względu na usytuowanie grupy -NH2 względem asymetrycznego węgla w trójwymiarowym modelu cząsteczki (dotyczy jedynie aminokwasów α ).
Aminokwasy L- grupa aminowa Aminokwasy D- grupa aminowa
położona jest po lewej stronie od położona jest po prawej stronie
asymetrycznego węgla w łańcuchu od asymetrycznego węgla w
głównym łańcuchu głównym
3. Ze względu na ilość grup -COOH i -NH2
- obojętne (1 grupa -NH2 , 1 grupa -COOH)
- kwaśne (1 grupa -NH2 , 2 grupa -COOH)
- zasadowe (2 grupa -NH2 , 2 grupa -COOH)
Ze względu na możliwość budowania białek:
- aminokwasy białkowe - to aminokwasy budujące białka. Wszystkie aminokwasy białkowe są α-aminokwasami. Istnieje 20 podstawowych rodzajów aminokwasów białkowych.
AMINOKWASY
Białkowe Niebiałkowe
aminokwasy wymienione * aminokwasy o różnej budowie na ostatnich 5 slajdach i funkcjach nie budujące białek
np.
* Ornityna, cytrulina
* Allicyna
Tauryna
Karnityna
Kwas γ-aminomasłowy
5. Ze względu na metabolizm: aminokwasy glukogenne rozkładane do: pirogronianu α-ketoglutaranu, bursztynolo-CoA, fumaranu, szczawiooctanu: Ala. Gly, Thr, Cys, Ser, Trp, Arg, Glu, Gln, His, Pro, Met, Val, Asp, Phe, Tyr, Asn, Asp. Aminokwasy ketogenne rozkładane np. do: acetylo-CoA, Ile, Leu, Trp, Phe, Tyr, Lys. Aminokwasy gluko- i ketogenne: Ile, Phe, Tyr.
Ze względu na polarność grup R w sąsiedztwie węgla
α: polarne (hydrofilowe), niepolarne (hydrofobowe).
Polarne |
Niepolarne |
Arginina Kwas asparaginowy Asparaginowy Cysteina Kwas glutaminowy Glutaminiany Glicyna Histydyna Lizyna Seryna Treonina Tyrozyna |
Alanina Izoleucyna Leucyna Metionina Fenyloalanina Prolina Tryptofan Walina |
AMINOKWASY
EGZOGENNE: ENDOGENNE:
Fenyloalanina 1. Alanina
Izoleucyna 2. Asparagina
Leucyna 3. Cysteina
Lizyna 4. Glutamina
Metionina 5. Glicyna
Treonina 6. Kwas asparaginowy
Tryptofan 7. Kwas glutaminowy
Walina 8. Seryna
u dzieci także: 9. Prolina
Histydyna względnie egzogenne:
Arginina 10. Histydyna
11. Arginina 12. Tyrozyna
Zbilansowany posiłek dostarcza aminokwasów egzogennych.
Właściwości ogólne aminokwasów
są rozpuszczalne w wodzie,
są nierozpuszczalne w rozpuszczalnikach organicznych (np. w eterze),
wszystkie charakteryzują się bardzo wysoką temperaturą topnienia,
mają podwójną naturę ze względu na ich budowę:
* kwasową- ze względu na występowanie grupy karboksylowej -COO-
* zasadowa- ze względu na występowanie grupy aminowej -NH3+
występują powszechnie w organizmach roślinnych i zwierzęcych,
SCHEMAT JONIZACJI AMINOKWASÓW
Aminokwasy są związkami o charakterze amfoterycznym stąd w zależności od wartości pH mogą posiadać ładunek + lub-
Ponieważ aminokwasy zawierają zarówno grupę kwasową i zasadową występują głównie w formie jonu obojnaczego, który jest rodzajem soli wewnętrznej;
+H3N-R-COO- (jon obojnaczy)
Punkt izoelektryczny- aminokwasu (pl) jest to takie pH, przy którym istnieje dokładna równowaga między formą kationową i anionową aminokwasu i występuje on wówczas głównie jako obojętny jon obojnaczy. Punkt ten jest charakterystyczny dla danego aminokwasu i zależy od jego struktury.
WIĄZANIE PEPTYDOWE
Cząsteczki aminokwasów mogą ze sobą reagować
PEPTYDY
Związki zbudowane z kilku (co najmniej dwóch) reszt aminokwasowych
….(2-10)- oligopeptydy.... 11-100- polipeptydy.......101- białka.
Przykłady naturalnych peptydów
Glutation- tripeptyd występuje prawie we wszystkich komórkach żywych organizmów. Jest antyutleniaczem i aktywatorem pewnych enzymów.
Oksytocyna- wywołuje skurcze mięśni gładkich ciężarnej macicy, a wraz z prolatyną stymuluje laktację. Natomiast najważniejszym zadaniem wazopresyny jest regulowanie stężenia moczu.
Insulina, 51- poptyd wytwarzanych w trzustce należy do jednych z najlepiej znanych peptydów, ponieważ jest powszechnie stosowanym lekiem przez diabetyków.
Białka
Biopolimery wielocząsteczkowe zbudowane z aminokwasów połączonych wiązaniem peptydowym
Głównymi pierwiastkami wchodzącymi w skład białek są: C,O, H, N, S oraz P
W układach biologicznych pełnią kluczowe funkcje
Są syntetyzowane na rybosomach w oparciu o informacje zawartą w mRNA
Białka proste (proteiny) zbudowane jedynie z aminokwasów stanowią niezliczoną grupę, któe zawieraja trwale wbudowany składnik niebiałkowy, np. cukrowy, lipidowy, ortofosforan, jon metalu, składnik barwny lub kwasy nukleinowe.
I- Białka proste (proteiny II- Białka złożone
włókienkowe (skleroproteiny) - glikoproteidy
globularne - glikoproteidy
właściwe - lipoproteidy
- histony - fosfoproteidy
- albuminy - hemoproteidy
- globuliny - chromoproteidy
- prolaminy - nukleoproteidy
- gluteiny
polipeptydy
- ..................
Białka wykazują różnorodną aktywność biologiczną:
kataliza enzymatyczna
transport i magazynowanie- hemoglobina, transferyna
kontrola przenikalności błon- regulacja stężenia metabolitów w komórce
ruch uporządkowany- np. skurcz mięśnia, aktyna i miozyna
wytwarzanie i przekazywanie impulsów nerwowych
kontrola wzrostu i różnicowania
immunologiczna
budulcowa, strukturalna
regulatorowa- reguluje przebieg procesów biochemicznych
Mniej lub bardziej sztywna budowa przestrzenna białek zwana STRUKTURĘ lub KONFORMACJĄ pozwala danemu białku pełnić jego funkcję biologiczną.
W budowie białek wyróżnia się kilka poziomów organizacji ich struktury : I, II, III i IV- rzędową.
STRUKTURA PIERWSZORZĘDOWA to liniowa sekwencja kolejnych aminokwasów połączonych wiązaniami peptydowymi. Wszystkie polipeptydy, z wyjątkiem cyklicznych, mają dwa różne końce, mianowicie N- i C- koniec. Struktura pierwszorzędowa polipeptydu zdeterminowana jest genetycznie.
Struktura drugorzędowa to regularne pofałdowane w przestrzeni szkieletu polipeptydowego. Szkielet każdego polipeptydu stanowią płaszczyzny wiązań peptydowych poprzedzielane atomami C. na zewnątrz od szkieletu peptydowego sterczą łańcuchy boczne aminokwasy ( R ). najpowszechniejszymi sposobami fałdowania polipeptydów są α-helisa i struktura-β, czyli harmonijkowa lub pofałdowanej kartki. Struktura α-helisy jest najkorzystniejsza energetycznie, stabilizowana wieloma wiązaniami wodorowymi.
STRUKTURY II-RZĘDOWE BIAŁEK
Struktura trzeciorzędowa- to przestrzenne ułożenie całego polipeptydu, czyli jego kształt, który jest stabilizowany wzajemnymi oddziaływaniami bocznych reszt aminokwasowych. Przestrzenna konformacja polipeptydu utrzymuje się dzięki różnym oddziaływaniom i wiązaniom, przedstawionym na poniższym rysunku:
Oddziaływania te sprawiają, że liniowe rejony szkieletu polipeptydowego zginają się i fałdują w przestrzeni tak, że zbliżają do siebie odległe liniowo sekwencje. Ostateczny kształt polipeptydu może być dwojaki, globularny lub fibrylarny. Globularne polipeptydy mają kształt zbliżony do kulistego, natomiast fibrylarne polipeptydy mają kształt wydłużony, prosty.
Struktura czwartorzędowa- jest najwyższym poziomem organizacji białek, zbudowanych z dwóch lub więcej polipeptydów, dotyczy zatem jedynie białek oligomerycznych . Struktura czwartorzędowa określa wzajemne położenie i oddziaływanie poszczególnych polipeptydowych podjednostek składających się na kształt białka oligomerycznego. Oddziaływaniami tymi mogą być wiązania kowalencyjne, mianowicie wiązania disiarczkowe, lub wiązania wodorowe, oddziaływania hydrofobowe i jonowe.
WŁAŚCIWOŚCI BIAŁEK
Białka są na ogół rozpuszczalne w wodzie. Do białek nierozpuszczalnych w wodzie należą tzw. białka fibrylarne, występujące w skórze, ścięgnach, włosach (kolagen, keratyna) lub mięśniach (miozyna). Niektóre z białek mogą rozpuszczać się w rozcieńczonych kwasach lub zasadach, jeszcze inne w rozpuszczalnikach organicznych. Na rozpuszczalność białek ma wpływ stężenie soli nieorganicznych w roztworze, przy czym małe stężenie soli wpływa dodatnio na rozpuszczalność białek (wsalanie). Przy większym stężeniu następuje uszkodzenie otoczki solwatacyjnej, co powoduje wypadanie białek z roztworu (wysalanie). Proces ten nie narusza struktury białka, więc jest odwracalny. Białka posiadają zdolność wiązania cząsteczek wody. Efekt ten nazywany hydratacją.
DENATURACJA BIAŁEK
Denaturacja polega na zniszczeniu (w różnym stopniu) struktury II-, III- lub IV-rzędowej białka, czyli natywnej konformacji, czego konsekwencją jest utrata specyficznych biologicznych aktywności białek. Denaturacja białek zachodzi pod wpływem różnych czynników, zarówno chemicznych jak i fizycznych. Zjawisko to obserwujemy pod wpływem wysokiej temperatury, mocnych kwasów lub zasad nieorganicznych, niektórych kwasów organicznych, rozpuszczalników organicznych, takich jak alkohol lub aceton w temperaturze pokojowej, oraz kationów metali ciężkich.
ENZYMY-BUDOWA I MECHANIZMY DZIAŁANIA
Enzymy- mogą być białkami prostymi, jednak większa część enzymów stanowi białka złożone, w których obok proteiny występuje ściśle z nią związana grupa prostetyczna. Inne wiążą się w sposób odwracalny z grupą niebiałkową i wówczas część białkowa nazywa się apoenzymem, grupa niebiałkowa- koenzymem, a całość- holoenzymem.
Holoenzym=apoenzym+koenzym
Jeden składnik holenzymu bez drugiego nie przejawia katalitycznego działania, czyli enzym jest aktywny tylko wówczas, gdy oba komponenty są połączone ze sobą. Apoenzym wykazuje powinowactwo do substratu, a więc decyduje o specyficzności substratowej, a grupa niebiałkowa określa kierunek przemiany substratu. Istotną funkcję w katalizie enzymatycznej spełnia tzw. centrum aktywne, będące specyficznie pofałdowanym fragmentem łańcucha polipeptydowego.
Enzymy katalizują reakcje termodynamicznie możliwe, zmniejszając jedynie energię aktywacji cząsteczek substratu, czyli energię niezbędną do przebiegu reakcji, przyspieszają dzięki temu osiągnięcie stanu równowagi reakcji.
BUDOWA I ROLA CENTRUM AKTYWNE
Miejsce aktywne (centrum aktywne, centrum katalistyczne) stanowi część enzymu, która jest odpowiedzialna z właściwy akt katalizy poprzez bezpośrednie obniżenie energii aktywacji. Oddziaływanie enzymu z substratem w jego obrębie sprzyja powstawaniu i stabilizacji stanu przejściowego.
Miejsce aktywne, stanowi trójwymiarową szczelinę (zagłębienie) w cząsteczce enzymu. Ma ono zazwyczaj charakter hydrofobowy, jest niedostępne dla wody. Zajmuje ono stosunkowo mała część całkowitej objętości enzymu. W wiązaniach substratu bierze udział wiele słabych oddziaływań (oddziaływania elektrostatyczne, wiązanie wodorowe, siły van der Vaalsa).
W skład centrum aktywnego wchodzą aminokwasy leżące blisko siebie w trójwymiarowej cząsteczce, choć często należą one do różnych łańcuchów polipeptydowych lub są one znacznie od siebie oddalone w sekwencji białka.
Ze względu na kształt cząsteczki substratu enzym nie może katalizować reakcji
Podstawą reakcji enzymatycznej jest utworzenie kompleksu ES
gdy struktura substratu jest dopasowana do struktury centrum aktywnego enzymu, wówczas mówimy o tzw. teorii klucza i zamka.
Emil Fischer (1890),
struktury enzymu i substratu nie są do końca sztywne i podlegają modyfikacji wynikającej z indukcyjnego dopasowania się enzymu do substratu. Teorie tę nazywamy teorią Koshlanda inaczej teorią indukcyjnego dopasowania się (kompleks ES)
Dan Koshland (1958),
atomy lub grupy atomów w cząsteczce substratu (S) łączą się z komplementarnymi miejscami w centrum aktywnym enzymy tylko w jeden możliwy sposób. Teorię tę nazywamy modelem „trzypunktowego dołączenia”
Alexandra Ogstona (1948),
NAJWAŻNIEJSZE TYPY SPECYFICZNOŚCI SUBSTRATOWEJ:
Specyficzność absolutna- polega na tym, że enzym może przekształcić tylko jeden związek jako substrat np. ureaza lub mocznik jako substrat.
Specyficzność grupowa- enzym może katalizować przekształcanie kilku związków jako substraty. Związki te muszą charakteryzować się wspólną cechą np. fosfatazy przekształcają monoestry fosforanowe.
Specyficzność stechiometryczna:
- Specyficzność do izometrii cis lub trans np. hydroliza jabłczanowa przyłącza cząsteczkę wody tylko do fumaranu (trans).
PODZIAŁ ENZYMÓW ORAZ ZADANIE KAZDEJ KLASY
Klasy enzymów wg klasyfikacji międzynarodowej:
Klasa 1: oksydoreduktazy- przenoszą ładunki (elektrony i jony H3O- protony) z cząsteczki substratu na cząsteczkę akceptora
AH2 + B----- A+ BH2
Klasa 2: transferazy- przenoszą daną grupę funkcyjną (tiolową, aminową, itp.) z cząsteczki jednej substancji na cząsteczkę innej substancji:
AB+C---A+BC;
Klasa 3: hydrolazy- powodują rozpad substratu pod wpływem wody (hydroliza); do grupy tej należy wiee enzymów trawiennych;
AB+H2O----A+B;
Klasa 4: liazy- powodują rozpad substratu bez hydrolizy; AB---A+B;
Klasa 5: izomerazy- zmieniają wzajemnie położenie grup chemicznych bez rozkładu szkieletu związku AB---BA;
Klasa 6: ligazy- powodują syntezę różnych cząsteczek, powstają wiązanie chemiczne A+B---AB;
Oksydoreduktazy- są enzymami katalizującymi reakcje utleniania i redukcji. Przenoszą ładunki (elektrony i protony) z jednej cząsteczki (reduktor) na inną (utleniacz), czyli akceptor.
AH + B ---- A + BH (redukcja)
A + O ---- AO (utlenianie)
Transferazy- są klasą enzymów katalizujących reakcję przeniesienia grupy chemicznej (np. tiolowej (SH-), aminowej, metylowej czy fosforanowej) lub atomu z jednej cząsteczki (donora) na drugą (akceptora).
AB + C --- A + BC
Hydrolazy- są enzymami rozcinające wiązanie chemiczne w procesie hydrolizy (przy udziale cząsteczki wody). Do grupy tej należy wiele enzymów trawiennych. Cecha charakterystyczną hydrolaz jest fakt, że nie posiadają one koenzymów.
AB + H2O --- A-H + B-OH
Liazy są enzymami katalizującymi odwracalnie lub nieodwracalnie odszczepienie grup bez udziału wody.
RCOCOOH --- RCOH + CO2
Izomerazy są enzymami zmieniającymi układ atomów w cząsteczce (nie dodają żadnych atomów, ani nie odcinają jedynie zmieniają ich ułożenie) przenoszą w obrębie cząsteczki pojedyncze atomy lub całe ich grupy.
AB --- BA
Ligazy (syntezy) są enzymami, które katalizują powstawanie wiązań chemicznych pomiędzy cząsteczkami, zużywając do tego energię pochodzącą z hydrolizy ATP. W zależności od typu tworzonego wiązania (C-O, C-S, C-N, lub C-C) dzielą się na podklasy.
A + B --- AB
Czynniki wpływające na szybkość reakcji enzymatycznej
stężenie substratu i enzymu
temperatura
pH środowiska
obecność aktywatorów i inhibitorów enzymów
Wpływ pH- każdy enzym posiada optymalne pH swojego działania. Niewielkie odchylenie od optimum powodują zwolnienie szybkości reakcji. Wynika to stąd, że jony H+ bądź też OH- zmieniają stopień dysocjacji grup funkcyjnych enzymu. Dotyczy to zwłaszcza grup funkcyjnych obecnych w centrum aktywnym i znajdujących się w bliskim sąsiedztwie centrum aktywnego.
Temperatura- każdy enzym posiada temperaturę optymalną tj. taką przy której stopień denaturacji enzymu jest jeszcze niewielki, a temperatura enzymu zależy od warunków, w których te enzymy funkcjonują. Ponieważ enzymy są białkami stąd też wraz ze wzrostem temperatury rośnie intensywność denaturacji tych białek. Z drugiej strony reakcje enzymatyczne podlegają tym samym prawom co inne reakcje chemiczne np. prawu Van i Hoffa. Prawo Van i Hoffa mówi, że wzrost temperatury o 10 st. może przyspieszyć 2-3 krotnie szybkość reakcji.
Stężenie enzymu- w warunkach nadmiaru substratu szybkości reakcji enzymatycznej jest wprost proporcjonalna do stężenia enzymu i do czasu reakcji.
Stężenie substratu- w warunkach niskich stężeń substratu obserwuje jedynie częściowe wysycenie enzymu substratu. Szybkość reakcji jest proporcjonalna do zwiększonego stężenie substratu. Przy dalszym wzroście stężenia substratu obserwuje się przyrost szybkości reakcji, lecz zależność ta nie jest już wprost proporcjonalna. Wynika to z faktu, że coraz większa część cząsteczek enzymu jest wysycona substratem i tylko niektóre cząsteczki enzymu są wolne i wchodzą po raz pierwszy w reakcję powodując jej przyspieszenie. Przy dalszym zwiększeniu stężenia substratu osiąga się maksymalną szybkość reakcji (Vmax) przy której wszystkie cząsteczki enzymu są …....one substratem.
Występowanie w białkach:
*Protogenne
* Nieprotogenne
Rodzaj i polarność rodnika:
* Alifatczne i aromatyczne
* Polarne i niepolarne
Miejsce syntezy:
* Endogenne
* Egzogenne
Przemiany szkieletów:
* Glikogenne
* Ketogenne
* Glikoketogenne
Wyszukiwarka
Podobne podstrony:
11 BIOCHEMIA horyzontalny transfer genów
Biochemia z biofizyką Seminarium 2
Podstawy biochemii
08 BIOCHEMIA mechanizmy adaptac mikroor ANG 2id 7389 ppt
BIOCHEMICZNE EFEKTY STRESU (2B)
Biochemia, ATP
biochemia krwi 45
ENZYMY prezentacja biochemia
biochemia stresu
04 BIOCHEMIA
05 BIOCHEMIA Zw wysokoenergetyczne ATP
Biochemia 4 Lipidy
Biochemia TZ wyklad 12 integracja metabolizmu low
Biochemia cz 4
biochemia cukry instrukcja id 8 Nieznany (2)
Opracowane pojecia biochemiczne(1)
Energetyka reakcji biochemicznych
więcej podobnych podstron