geoinfo.amu.edu.pl/wngig/IG/index.html
dyżur wtorek 10:00 - 11:30, p. L205
Chemia
nauka przyrodnicza zajmująca się substancjami zarówno naturalnymi jak i otrzymywanymi sztucznie, ich składem, budową, właściwościami, przemianami, jakim ulegają warunkami wpływającymi na kierunek, szybkość i zasięg tych przemian oraz energią im towarzyszącą.
Nowsze definicje chemii opierają się na założeniu, że zasadniczo każda przemiana chemiczna polega na przesunięciu elektronów
Chemia jest nauką ścisłą posługująca się w dużej mierze matematyką, tak więc wyniki przemian chemicznych ujmuje się liczbowo, a prawa i uogólnienia dotyczące zjawisk chemicznych wyraża się za pomocą wzorów matematycznych,. Chemia, jak prawie wszystkie nauki przyrodnicze, jest zarazem nauką doświadczalną, badania swe chemicy opierają nie tylko na procesach przebiegających samorzutnie w przyrodzie, lecz również na przemianach wywołanych sztucznie, w ścisle określonych i dających się wytworzyć warunkach
chemia ogólna, organiczna, nieorganiczna, fizyczna, analityczna
centy 1cg = 0,01g
mili 1mg = 10 -3
ikro 1μg = 10 -6
nano 1ng = 10 -9
piko 1pg = 10 -12
fento 1fg = 10 -15
1 ppm = 1mg/litr/kg
1 ppb = 1 μg/litr/kg
1 ppt = 1ng/litr/kg
1 ppq = 1 pg/litr/kg
Substancja to rodzaj materii, charakteryzujący się określonymi właściwościami i stałym składem chemicznym.
Substancje proste to substancje, których nie można rozłożyć na prostsze metodami chemicznymi. Substancjami prostymi są pierwiastki.
Substancje złożone, to substancje, które można rozłożyć na substancje prostsze metodami chemicznym - związki chemiczne.
Pierwiastek chemiczny to zbiór atomów o tej samej liczbie atomowej.
Związek chemiczny to jednorodna substancja zawierająca dwa lub więcej pierwiastków chemicznych, których atomy lub jony są połączone ze sobą w uporządkowany sposób, z zachowaniem określonych stosunków ilościowych.
Notacja chemiczna pierwiastków i związków chemicznych - ...
Reakcja chemiczna to proces, podczas którego z jednej lub kilku substancji (substratów) powstają inne substancje o odmiennych właściwościach (produkty).
Wydajnością reakcji chemicznej nazywamy stosunek ilości produktu uzyskanego w reakcji do ilości tego produktu obliczonej teoretycznie z równania reakcji dla tej samej ilości substratów.
W(%) = uzyskana ilość produktu / teoretyczna ilość produktu * 100%
Równanie reakcji chemicznej, to zapis przebiegu reakcji chemicznej za pomocą symboli, wzorów i znaków np.:
N2(g) + 3H2(g) → 2NH3(g)
Każdą reakcję chemiczną można przedstawić przy pomocy równań chemicznych. Aby to uczynić należy znać produkty i substraty danej reakcji oraz pamiętać że lewa i prawa strona równania muszą być sobie równe
Reakcja syntezy - polega na łączeniu się dwu lub więcej pierwiastków względnie cząsteczek w związki chemiczne
A + B → AB
2H2 + O2 → 2H2O
H2 + S → H2S (siarkowodór)
SO2 + H2O → H2SO3
Reakcja analizy - dotyczy reakcji, w wyniku których z jednej substancji tworzą się dwie lub więcej substancji prostszych.
AB → A + B
2HgO → 2Hg + O2
Na2CO3 → Na2O + CO2
Reakcja wymiany - polega na zastąpieniu jonów lub atomów tworzących substraty w wyniku reakcji chemicznych
AB + C → AC + B
Zn + H2SO4 → ZnSO4 + H2
CuSO4 + Fe → FeSO4 + Cu
Reakcja wymiany podwójnej
AB + CD → AD + CB
2NaOH + H2SO4 → Na2SO4 + 2H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
Współczynniki w równaniach chemicznych
Ułożyć równanie reakcji pomiędzy FeCl3 i AgNO3
FeCl3 + AgNO3 → AgCl + Fe(NO3)3
Żeby liczba atomów po jednej i drugiej stronie równania reakcji były sobie równe, należy potroić ilość AgNO3.
FeCl3 + 3AgNO3 → 3AgCl + Fe(NO3)3
Stężenia procentowe Cp [%]
Procent masowy (wagowy) substancji rozpuszczonej w roztworze
Cp = ms / mt * 100%
ms - masa substancji rozpuszczonej
mt - masa roztworu
mt = ms + mrozp
mrozp - masa rozpuszczalnika
Stężenie procentowe może być podawane również w procentach objętościowych. Wówczas masy: ms, mt, mrozp zastępujemy objętościami Vs, Vt, Vrozp
Stężenie molowe Cm [mol * dm -3]
Cm = n/Vt
n - liczba moli substancji rozpuszczonej
Vt - objętośc roztworu
n = m/M
m - masa substancji
M - masa molowa substancji
Przeliczanie stężeń
Cm = Cp * d / 100% * M
Cm - stężenie molowe roztworu [mol * dm-3]
Cp = Cm * M * 100% / d
d - gęstość roztworu [g*dm-3]
Gęstość substancji d [kg*m-3]
to stosunek masy substancji (m) do jej objętości (V)
d = m/V
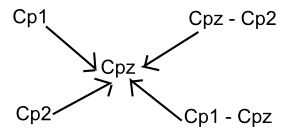
Reguła mieszania roztworów
O stężeniach procentowych Cp1 i Cp2 w celu uzyskania roztworu stężeniu Cpz, gdzie Cp1> Cpz>Cp2
m1/m2 = Cpz - Cp2 / Cp1 - Cpz
m1 - masa roztworu o stężeniu Cp1
m2 - masa roztworu o stężeniu Cp2

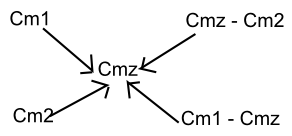
O stężeniach molowych Cm1 i Cm2 w celu uzyskania roztworu o stężeniu Cmz, gdzie Cm1>Cmz>Cm2
V1/V2 = Cmz - Cm2 / Cm1 - Cmz
Zmieszano 250g 48% roztworu NaOH z 250g 10% roztworu NaOH. Obliczyć stężenie
Cp = ms /mr * 100%
krzyżowa reguła mieszania

(x - 10) / (48 - x) = 250/250
(x - 10) / (48 - x) = 1
(x - 10) = (48 - x)
2x = 58
x = 29%
Do 300g 40% roztworu KNO3 dodano 500g H2O.
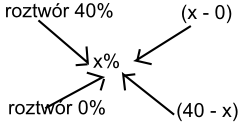
X / 40 - x = 300 / 500
5x = 3 (40 - x)
8x = 120
x = 15%
Stężenia molowe
Oblicz ile gram kwasu ortofosforowego znajduje się w 350cm3 0,2 molowego roztworu
masa molowa H3PO4 = 98g
350cm3 = o,35 dm3
1dm3 * 1 molowego roztworu - 98g H3PO4
o,35dm3 * 0,2 molowego roztworu - xg H3PO4
x = 0,35 * 0,2 * 98 / 1 * 1
x = 6,86g H3PO4
Stopień utlenienia to liczba elementarnych ładunków dodatnich lub ujemnych, jakie pojawiły się na atomie tego pierwiastka, gdyby rozpatrywany związek miał budowę jonową.
Stopień utlenienia oznaczany liczbami rzymskimi nad symbolem pierwiastka, stawiając przed liczbą znak „-”, gdy ładunek jest ujemny.
Substancja chemiczna |
Stopień |
Przykład |
Zapis |
|
|
Pierwiastek w stanie wolnym |
0 |
Cu, Br2 |
|
|
|
Wodór w związkach |
Z pierwiastkami o elektroujemności > 2,1 |
I |
H2O, NaOH, HNO3, C2H4 |
|
Elektroujemność wodoru wg skali Paulinga = 2,1 |
|
Z pierwiastkami o elektroujemności < 2,1 |
-I |
CaH, NaH |
|
|
Tlen w związkach |
W tlenkach, wodorotlenkach, kwasach i solach, związkach organicznych |
-II |
H2O, KOH, H2SO4, K2SO4 |
|
Elektroujemność tlenu wg skali Paulinga = 3,5 |
|
W nadtlenkach |
-I |
H2O2, BaO2 |
|
|
|
Z fluorem |
II |
OF2 |
|
|
Reakcje utleniania i redukcji (redox) - reakcje, podczas których następuje zmiana stopni utlenienia pierwiastków na skutek wymiany elektronów pomiędzy substancją utleniająca (utleniaczem - Utl) i redukcją (reduktorem - red).
Reduktor (elektronator) oddaje elektrony (jest donorem elektronów). Reduktor, oddając elektrony, utlenia się (ulega dezelektronacji)
Red - ze- → Ut
z - liczba oddanych elektronów
Utleniczach (dezelektronator) pobiera elektrony (jest akceptorem elektronów). Utleniacz, pobierając elektrony, redukuje się (ulega elektronacji)
Utl + ze- → Red
Np. tlen, fluorowce, ozon, manganian (VII) potasu
Dobieranie współczynników stechiometrycznych w równaniach reakcji redoks.
Aby dobrać współczynniki stechiometryczne należy:
obliczyć stopień utlenienia pierwiastków występujących w reakcji
ustalić utleniacz i reduktor reakcji
zapisać reakcje połówkowe dla utleniacza i reduktora
dokonać bilansu elektronów oddanych i pobranych
dobrać pozostałe współczynniki zgodnie z prawem zachowania masy i ładunku w reakcjach połówkowych
nanieść otrzymane współczynniki stechiometryczne z reakcji połówkowych do reakcji wyjściowej
8!
Stopnie utleniania w jonach złożonych
Suma stopni utlenienia wszystkich atomów w jonie złożonym jest równa ładunkowi tego jonu 9!
Stopnie utlenienia w cząsteczkach związków
Suma stopni utlenienia wszystkich atomów w cząsteczce i związku jonowym jest równa zero. 10!
Szczególne rodzaje reakcji redoks
Reakcje dysproporcjonywania
Iloczyn jonowy wody:
Kw = [H+] x [OH-] = 1 * 10 -14
pH = -log [H+]
pOH = -log [OH-]
pH + pOH = 14
W czystej wodzie [H+] = [OH-] = 1*10-7
pH = 7 r obojętny
pH >7 alkaliczny
pH <7 kwaśny
Obliczyć stężenie jonów [H+] w roztworze, w którym stężenie jonów [OH-] wynosi 10-8 mol/L
[H+] =Kw / [OH-]
10 -14 / 10 -8 = 10 -6 mol/L
[OH-] =kw / [H+]
Obliczyć pH 0.25% roztworu kwasu azotowego zakładając, ze kwas ten jest całkowicie zdysocjonowany.
obliczamy stężenie 0,25% kwasu azotowego (mol/L): 0,25% roztwór HNO3 zawiera 2,5g czystego HNO3
[HNO3] = 2,5 / 63,01 = 3,97 * 10-2 mol/L
[H+] = [HNO3] = 3,97 * 10-2 mol/L
pH = -log [3,97 *10 -2] = -0,60 + 2 =1,40 (kwaśny)