![]()
08.05.2012r.
Laboratorium z Biochemii
Kinetyka reakcji enzymatycznych (część II)
Prowadzący: dr inż. I. Romanowska
Aleksandra Kosiorek
Marta Wujek
Przemysław Woiński
Wstęp teoretyczny:
Enzymy są substancjami wytwarzanymi przez organizmy i odgrywającymi podstawową rolę jako katalizatory przemian chemicznych zachodzących zarówno wewnątrz organizmów, jak i po za nimi.
Kinetyka chemiczna bada szybkość z jaką zachodzą reakcje chemiczne. Chwilowa szybkość reakcji względem jakiegoś reagenta jest to zmiana jego stężenia w czasie mierzona w określonym momencie trwania reakcji. Jednostkami szybkości reakcji są jednostki stężenia podzielone przez jednostki czasu.
Teoretycznie wszystkie reakcje chemiczne (również katalizowane enzymatycznie) są odwracalne. Po pewnym czasie ustala się równowaga pomiędzy substratami reakcji a jej produktami, objawiająca się tym, że szybkość powstawania produktów jest równa szybkości ich rewersji do substratów. Szybkość powstawania produktów jest proporcjonalna do stężeń reagujących substratów. Szybkość reakcji rewersji produktów jest proporcjonalna do stężeń produktów.
Szybkość początkowa reakcji jest to szybkość wyznaczona przed powstaniem dostatecznie dużej ilości produktu, który by umożliwiał zachodzenie reakcji odwrotnej. Szybkość początkowa reakcji enzymatycznej jest zawsze proporcjonalna do stężenia enzymu. Stąd oznaczenie ilości enzymu (jego aktywności) powinno być oparte, o ile jest to możliwe, na pomiarach początkowej szybkości reakcji przy znacznym nadmiarze substratu. W takim układzie szybkość reakcji nie zależy od stężenia substratu i reakcja jest rzędu zerowego.
Model Michaelisa-Menten opiera się na założeniu powstawania przejściowego kompleksu enzymu-substrat:
![]()
Zgodnie równaniem, przy niewielkich stężeniach substratu - równoważnym stężeniom enzymu - reakcja enzymatyczna staje się reakcją I rzędu i jej szybkość staje się proporcjonalna do stężenia zarówno substratu [S], jak i enzymu [E]. Przy stałym stężeniu enzymu [E] szybkość reakcji będzie zależała jedynie od stężenia substratu.
Dla pewnych stężeń substratu - równoważnym ilościom dostępnych centrów aktywnych enzymu - reakcja osiągnie szybkość maksymalną, a dalsze zwiększanie stężenia substratu nie przyspiesza jego przemiany.
Źródła:
„Kompendium Biochemii” T. P. Trzmiel
„Biochemia. Krótkie wykłady” D. Hames, N. Hooper
„Nowoczesne kompendium chemii” K.H. Lautenschlager, W. Schroter, A. Wanninger
Część doświadczalna:
Tabela 1. Wyznaczenie krzywej progresji reakcji i obliczanie początkowej szybkości reakcji.
|
Wyznaczenie krzywej progresji reakcji i obliczanie początkowej szybkości reakcji |
|||
Cel |
Celem doświadczenia jest oznaczenie przedziału czasu, w którym reakcje rozkładu sacharozy pod wpływem β-fruktofuranozydazy ma charakter zerowego rzędu. |
|||
Użyte odczynniki |
|
|||
Przebieg doświadczenia |
W próbie właściwej przygotowaliśmy 6 probówek z mieszaniną sacharozy i enzymu, które inkubowaliśmy w temperaturze pokojowej przez odpowiednio: 2x 5 minut, 2x 10 minut i 2x 20 minut. Po tym czasie przerwaliśmy dla każdej z mieszanin reakcję hydrolizy dolewając do roztworu DNS. Po wymieszaniu, inkubowaliśmy je przez 5 minut we wrzącej łaźni wodnej, następnie schłodziliśmy i dodaliśmy 8 ml wody destylowanej. W próbie kontrolnej pominęliśmy proces inkubacji w temperaturze pokojowej - od razu wymieszaliśmy wszystkie odczynniki i dalej postępowaliśmy tak jak w próbie właściwej. Dla wszystkich próbek badaliśmy absorbancję przy długości fali λ = 540 nm. |
|||
Absorbancja |
próba 1 [5 min.] |
0,1181 |
średnia [5 min.] |
0,1270 |
|
próba 2 [5 min.] |
0,1359 |
|
|
|
próba 3 [10 min.] |
0,2387 |
średnia [10 min.] |
0,2412 |
|
próba 4 [10 min.] |
0,2437 |
|
|
|
próba 5 [20 min.] |
0,4668 |
średnia [20 min.] |
0,4766 |
|
próba 6 [20 min.] |
0,4863 |
|
|
|
próba kontrolna |
0,0089 |
||
|
próba 5 min. |
0,1181 |
||
|
próba 10 min. |
0,2323 |
||
|
próba 20 min. |
0,4677 |
||
Współczynnik nachylenia krzywej wzorcowej k=5,5 (dla A540=0,1 stężenie cukrów redukujących w 1 ml wynosi 0,55)
Przyrost stężenia cukrów redukujących uwolnionych w różnym czasie reakcji wyliczyliśmy ze wzoru:
![]()
∆P5 min.= 0,1181∙ 5,5 ∙ 2=1,2991
∆P10 min.= 0,2323 ∙ 5,5 ∙ 2=2,5553
∆P20 min. = 0,4677 ∙ 5,5∙ 2=5,1447
wykres 1.
Początkowa szybkość reakcji enzymatycznej równa jest tangensowi kąta między osią OX, a styczną do krzywej funkcji P=f(t):
![]()
![]()
Aktywność β-fruktofuranozydazy obliczamy ze wzoru:
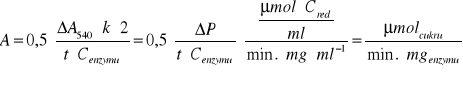
gdzie Cenzymu = 0,01 mg/ml
![]()
![]()
![]()
Wnioski:
Aktywność β-fruktofuranozydazy pozostaje zbliżona do siebie wraz z upływem czasu, a więc i szybkość reakcji oscyluje wokół tych samych wartości, a co za tym idzie można stwierdzić iż w tym czasie reakcja ta jest zerowego rzędu.
Tabela 2. Wyznaczenie wpływu stężenia substratu na szybkość reakcji enzymatycznej.
|
Wyznaczenie wpływu stężenia substratu na szybkość reakcji enzymatycznej |
|||
Cel |
Celem doświadczenia jest wyznaczenie wpływu stężenia substratu na szybkość reakcji enzymatycznej. |
|||
Użyte odczynniki |
|
|||
Przebieg doświadczenia |
W próbie właściwej przygotowaliśmy 8 probówek z mieszaniną sacharozy i enzymu (o różnych stężeniach, w dwóch powtórzeniach), które inkubowaliśmy w temperaturze pokojowej przez 10 minut. Po tym czasie przerwaliśmy dla każdej z mieszanin reakcję hydrolizy dolewając do roztworu DNS. Po wymieszaniu, inkubowaliśmy je przez 5 minut we wrzącej łaźni wodnej, następnie schłodziliśmy i dodaliśmy 8 ml wody destylowanej. W próbie kontrolnej pominęliśmy proces inkubacji w temperaturze pokojowej - od razu wymieszaliśmy odczynniki (w czterech próbach - po jednej dla każdego stężenia substratu) i dalej postępowaliśmy tak jak w próbie właściwej. Dla wszystkich próbek badaliśmy absorbancję przy długości fali λ = 540 nm. |
|||
Absorbancja |
próba 1 [31,2 mM] |
0,08 |
średnia [31,2 mM] |
0,075 |
|
próba 2 [31,2 mM] |
0,07 |
|
|
|
próba 3 [62,5 mM] |
0,135 |
średnia [62,5 mM] |
0,1325 |
|
próba 4 [62,5 mM] |
0,130 |
|
|
|
próba 5 [125 mM] |
0,175 |
średnia [125 mM] |
0,1775 |
|
próba 6 [125 mM] |
0,180 |
|
|
|
próba 7 [250 mM] |
0,140 |
średnia [250 mM] |
0,1375 |
|
próba 8 [250 mM] |
0,135 |
|
|
|
próba kontrolna [31,2 mM] |
0 |
||
|
próba kontrolna [62,5 mM] |
0 |
||
|
próba kontrolna [125 mM] |
0 |
||
|
próba kontrolna [250 mM] |
0 |
||
|
próba [31,2 mM] |
0,075 |
||
|
próba [62,5 mM] |
0,1325 |
||
|
próba [125 mM] |
0,1775 |
||
|
próba [250 mM] |
0,1375 |
||
Współczynnik nachylenia krzywej wzorcowej k=5,5 (dla A540=0,1 stężenie cukrów redukujących w 1 ml wynosi 0,55)
Przyrost stężenia cukrów redukujących uwolnionych w różnych roztworach wyliczyliśmy ze wzoru:
![]()
∆P31,2= 0,075∙ 5,5 ∙ 2=0,825
∆P62,5= 0,1325 ∙ 5,5 ∙ 2=1,458
∆P125 = 0,1775 ∙ 5,5∙ 2=1,953
∆P250 = 0,1375 ∙ 5,5∙ 2=1,513
Aktywność β-fruktofuranozydazy obliczamy ze wzoru:
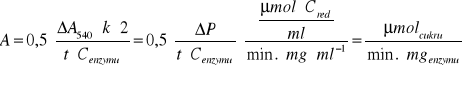
gdzie: Cenzymu = 0,01 mg/ml
t = 10 min.
dla jednakowego czasu reakcji szybkość początkowa reakcji równa się jej aktywności
![]()
![]()
![]()
![]()
wykres 2.
Wartość v250 została przez nas błędnie oznaczona co mogłoby negatywnie wpłynąć na poprawny wynik doświadczenia, toteż pomijamy ten punkt w dalszych obliczeniach.
wykres 3.
Na podstawie równania krzywej wyznaczam punkty jej przecięcia z osiami OX i OY:
0 = 5,9247x + 0,05 x = -0,00844
y = 5,9247 * 0 + 0,05 y = 0,05
wykres.4
Z tak otrzymanej krzywej odczytuje wartości ![]()
równe wartościom punktów przecięcia odpowiednio z osią OY i OX.
![]()
![]()
![]()
Wnioski:
Krzywa v0=f(Ssacharozy) ma charakter wielomianowy. Szybkość reakcji enzymatycznej rośnie wraz ze wzrostem stężenia substratu, aż do osiągnięcia wartości maksymalnej po czym nieznacznie spada, (co spowodowane zostało błędnym oznaczeniem próbki zawierającej 250 mM roztwór sacharozy) a dalsze zwiększanie jego stężenia nie przekłada się na wzrost szybkości reakcji. Dzieje się tak dlatego iż w mieszaninie reakcyjnej jest stała określona liczba cząsteczek enzymu zdolnego w jednym czasie połączyć się z cząsteczkami substratu katalizując jego przemianę w produkt.
Tabela 3. Wyznaczenie wpływu stężenia enzymu na szybkość reakcji enzymatycznej.
|
Wyznaczenie wpływu stężenia substratu na szybkość reakcji enzymatycznej |
|||
Cel |
Celem doświadczenia jest wyznaczenie wpływu stężenia enzymu na szybkość reakcji enzymatycznej. |
|||
Użyte odczynniki |
|
|||
Przebieg doświadczenia |
W próbie właściwej przygotowaliśmy 6 probówek z mieszaniną sacharozy i enzymu (o różnych rozcieńczeniach, w dwóch powtórzeniach), które inkubowaliśmy w temperaturze pokojowej przez 10 minut. Po tym czasie przerwaliśmy dla każdej z mieszanin reakcję hydrolizy dolewając do roztworu DNS. Po wymieszaniu, inkubowaliśmy je przez 5 minut we wrzącej łaźni wodnej, następnie schłodziliśmy i dodaliśmy 8 ml wody destylowanej. W próbie kontrolnej do roztworów enzymów najpierw dodaliśmy DNS a następnie roztwór sacharozy, wymieszaliśmy odczynniki (w trzech próbach - po jednej dla każdego rozcieńczenia enzymu) i dalej postępowaliśmy tak jak w próbie właściwej. Dla wszystkich próbek badaliśmy absorbancję przy długości fali λ = 540 nm. |
|||
Absorbancja |
próba 1 [0x]* |
0,15 |
średnia [0x] |
0,145 |
|
próba 2 [0x] |
0,14 |
|
|
|
próba 3 [2x] |
0,26 |
średnia [2x] |
0,25 |
|
próba 4 [2x] |
0,24 |
|
|
|
próba 5 [4x] |
0,36 |
średnia [4x] |
0,36 |
|
próba 6 [4x] |
0,36 |
|
|
|
próba kontrolna [0x] |
0 |
||
|
próba kontrolna [2x] |
0 |
||
|
próba kontrolna [4x] |
0 |
||
|
próba [0x] |
0,145 |
||
|
próba [2x] |
0,25 |
||
|
próba [4x] |
0,36 |
||
*znaki w nawiasach oznaczają stopień rozcieńczenia enzymu; 0x oznacza brak rozcieńczenia
Współczynnik nachylenia krzywej wzorcowej k=5,5 (dla A540=0,1 stężenie cukrów redukujących w 1 ml wynosi 0,55)
Przyrost stężenia cukrów redukujących uwolnionych w różnych roztworach wyliczyliśmy ze wzoru:
![]()
∆P0x= 0,145∙ 5,5 ∙ 2=1,595
∆P2x= 0,25 ∙ 5,5 ∙ 2=2,75
∆P4x = 0,36 ∙ 5,5∙ 2=3,96
Aktywność β-fruktofuranozydazy obliczamy ze wzoru:
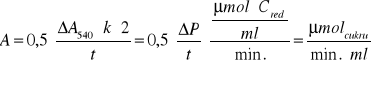
gdzie: t = 10 min.
dla jednakowego czasu reakcji szybkość początkowa reakcji równa się jej aktywności
![]()
![]()
![]()
wykres 5.
Wnioski:
W badanym przez nas zakresie stężeń możemy zaobserwować, że im wyższe jest stężenie enzymu tym reakcja przebiega szybciej. Zależność ta przebiega liniowo tylko w początkowym etapie zwiększania ilości enzymu, później krzywa zaczyna dążyć do wartości szybkości maksymalnej.