Amfoteryczność, amfolity |
Termin "amfoteryczność" określa specjalną własność substancji, która polega na jej zachowaniu się jak kwas lub jak zasada, zależnie od warunków. Substancje takie nazywamy substancjami amfiprotycznymi (amfolitami).
Zgodnie z teorią Brnsteda, amfolitami są substancje, które w reakcjach w roztworze mogą przyłączać bądź odłączać protony.
Najpospolitszym amfolitem jest woda: H2O + H+ H3O+ ; H2O OH + H+
Szczególnymi amfolitami są uwodnione jony (akwojony) metali. Typowym przykładem jest [Zn(OH)2]aq:
Zn(OH)2(H2O)2 + 2H3O+ Zn(H2O)42+ + 2H2O
Zn(OH)2(H2O)2 + 2OH Zn(OH)42 + 2H2O
Amfoteryczność tego (i innych) wodorotlenku objawia sie np. tym, że rozpuszczają się w kwasach i w zasadach.
Nie wszystkie wodorotlenki metali są amfolitami. Jeśli stała dysocjacji kwasowej wodorotlenku jest zbyt mała, wtedy słabo (lub wcale) nie rozpuszcza się on w zasadach. Drugim decydującym parametrem jest stężenie.
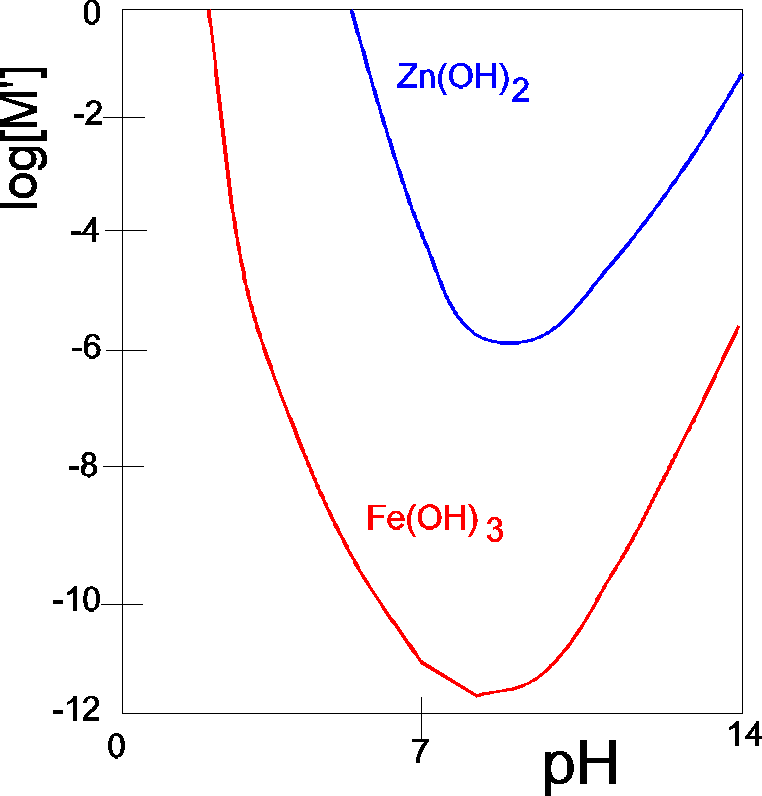
Tak więc AgOH (pKa=17.7) jest amfolitem, o ile jego stężenie jest 10-5 (wtedy rozpuszcza się w zasadach). Z kolei Fe(OH)3 (pKa=21.1) w ogóle nie jest zaliczany do amfolitów (rozpuszcza się w kwasach, ale w zasadach praktycznie nie).
|
Zależność logarytmu całkowitego stężenia jonów metalu w równowadze z osadem wodorotlenku od pH roztworu.
Zauważmy, że Zn(OH)2 (pKa=17.3) jest zaliczany do amfolitów, zaś Fe(OH)3 (pKa=21.1) nie. Kryterium jest więc tylko ilościowe. |
Do amfolitów należą, oprócz wodorotlenków metali przejściowych i niektórych metali grup głównych, także w szczególności:
częściowo sprotonowane aniony kwasów wielowodorotlenowych, np. jony HCO3:
HCO3 H+ + CO32
(reakcję opisuje stała K=Ka,2 dla H2CO3)
HCO3 + H2O OH + H2CO3
(reakcję opisuje stała K=Kw/Ka,1 dla H2CO3)
aminokwasy:
R.NH2.COOH R.NH2.COO + H+
R.NH2.COOH + H2O R.NH3+.COOH + OH
sole słabych kwasów i słabych zasad.
Zatem każdemu amfolitowi można przypisać dwie stałe dysocjacji kwasowej: amfolitu jako kwasu (Ka,1) i kwasu sprzężonego z amfolitem będącym zasadą (Ka,2).
Wzór (przybliżony) na [H+] roztworu amfolitu:
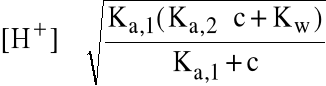
(nie trzeba pamiętać)
Jeśli c>>Ka,1 i Ka,2.c>>Kw, wtedy
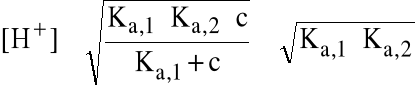
(trzeba pamiętać)
|
Przykład: oblicz pH 0.1 M roztworu K2HPO4.
(dla H3PO4 pKa,1=2.2, pKa,2=7.2, pKa,3=12.3)
K2HPO4 jest solą, zatem dysocjuje całkowicie. Roztwór zawiera więc (prawie!) 0.1 M jonów HPO42. Jony te są amfolitem, opiywanym stałą pKa,2=7.2 (jako zasada sprzężona z kwasem H2PO4) i stałą pKa,3=12.3 (jako kwas HPO42). Korzystamy ze wzorów:
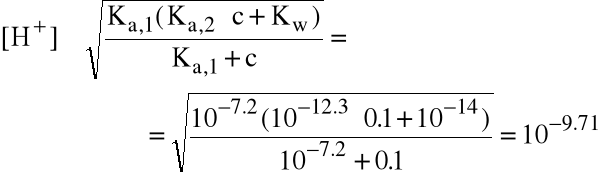
(pH=9.71)
Mniej dokładne wzory dają: 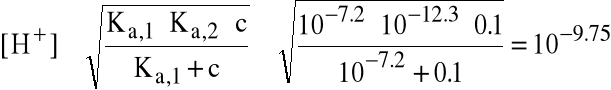
(pH=9.75)
oraz 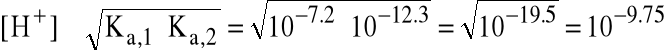
(pH=9.75)
|
Amfolitami są także sole słabego kwasu i słabej zasady.
Np. octan amonowy dysocjuje całkowicie na jony:
CH3COONH4 CH3COO + NH4
Jony te są, odpowiednio, słabą zasadą i słabym kwasem:
CH3COO + H2O CH3COOH + OH
NH4 + H2O NH3.H2O + H+
Także tutaj można zastosować ogólne wzory na [H+] amfolitów.
|
Przykład: oblicz pH 0.01M roztworu CH3COONH4 (pKa,CH3COOH=4.8, pKa,NH4+=9.2)
Korzystamy z najprostszego wzoru (dokładniejszy nie jest tu potrzebny - proszę sprawdzić):
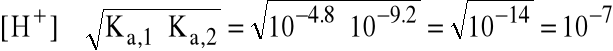
czyli pH=7
(moce kwasu NH4 i zasady CH3COO są jednakowe).
Uwaga: |
Jeśli stężenie amfolitu oraz moce jego składników (kwasu i zasady) nie są zbyt małe, wtedy pH roztworu praktycznie nie zależy od stężenia amfolitu i od proporcji kwas:zasada. Tak więc amfolity zachowują się podobnie do buforów.
Skale kwasowości w różnych rozpuszczalnikach |
Najważniejszymi własnościami rozpuszczalników (z punktu widzenia teorii kwasów i zasad) są ich własności donorowo-akceptorowe oraz stała dielektryczna.
Podział ogólny:
rozpuszczalniki cząsteczkowe (molekularne) - małe przewodnictwo, silna asocjacja: NH3, SO2, woda, acetamid;
rozpuszczalniki zjonizowane - duże przewodnictwo: najczęściej stopione sole;
ciekłe metale.
Ze względu na własności donorowo-akceptorowe:
bierne (aprotyczne) - nie reagują z kwasami lub zasadami (węglowodory i podobne);
czynne (protolityczne) - mogą reagować z kwasami (zasadowe, protonoakceptorowe: pirydyna, ketony, etery) lub z jednymi i drugimi (amfiprotyczne: woda, alkohole, amoniak, kwasy organiczne).
(Zauważmy, że nie są znane rozpuszczalniki, które reagowałyby wyłącznie kwasowo).
Skale kwasowości (zasadowości) są dla danego rozpuszczalnika skalami pH (z pewnymi ograniczeniami). Dla rozpuszczalników aprotycznych skala ta nie jest ograniczona z żadnej strony. Dla rozpuszczalników zasadowych skala pH jest ograniczona jednostronnie, zaś dla amfiprotycznych - obustronnie. Tak więc np. w etanolu skala pH rozciąga się od 0 do 18.9.
Rozpuszczalnik |
kation |
anion |
iloczyn jonowy w 25o |
stała dielektryczna |
acetamid |
CH3CONH3+ |
CH3CONH |
14.61) |
59.21) |
acetonitryl |
CH3CNH+ |
CH3CN |
19.5 |
36.2 |
amoniak |
NH4+ |
NH2 |
322) |
22.42) |
dwumetylosulfotlenek (DMSO) |
C2H6SOH+ |
C2H5SO |
33.3 |
48.9 |
etanol |
C2H5OH2+ |
C2H5O |
18.9 |
24.3 |
kwas fluorowodorowy |
H2F+ |
F- |
10.73) |
83.63) |
kwas octowy |
CH3COOH2+ |
CH3COO |
15.2 |
6.2 |
kwas siarkowy |
H3SO4+ |
HSO4 |
2.9 |
110 |
metanol |
CH3OH2+ |
CH3O |
16.7 |
32.6 |
woda |
H3O+ |
OH |
14.0 |
81.0 |
1) w 100oC 2) w -60oC 3) w -33oC
© J. Gliński, w. 09, p. 2
Wyszukiwarka
Podobne podstrony:
W08s-Slabe kwasy i zasady wieloprotonowe, chemia, szkolka
zad. kompleksowanie, chemia, szkolka
zad. il. rozpuszcz., chemia, szkolka
zad. redox - potencj., chemia, szkolka
W02s-stezenia-pH, chemia, szkolka
W10s-rownowagi heterogeniczne-Iloczyn rozpuszczalnosci, chemia, szkolka
zad. statyst., chemia, szkolka
W04s-analiza nieorganiczna jakosciowa, chemia, szkolka
W05s-analiza subst. naturalnych, chemia, szkolka
W18S-kompleksy, chemia, szkolka
W15S-Reakcje utlenienia-redukcji, chemia, szkolka
W14S-Procesy utlenienia-redukcji, chemia, szkolka
W01s-chemia analityczna, chemia, szkolka
sciaga Chemia-amfoterycznosc, Chemia Fizyka Matma
zad. slabe kwasy, chemia, szkolka
W08s-Slabe kwasy i zasady wieloprotonowe, chemia, szkolka
więcej podobnych podstron