BIOCHEMIA
Enzymy
To białkowe biokatalizatory umożliwiające przebieg reakcji poprzez obniżanie reakcji aktywacji.
Nie zmieniają stanu równowagi chemicznej.
Jeżeli enzym jest białkiem złożonym (nie każdy enzym), to składa się z:
części białkowej nazywanej apoenzymem (decyduje ona o specyficzności lub kierunku jego działania)
części niebiałkowej nazywanej (w zależności od rodzaju wiązania łączącego ją z apoenzymem):
koenzymem (przeważnie są to witaminy rozp. w H2O lub jony luźno i odwracalnie złączone z apoenzymem)
grupą prostetyczną enzymu (trwale związana z enzymem wiązaniem kowalencyjnym lub niekowalencyjnym). Bierze ona udział w reakcji enzymatycznej.
Apoenzym + Koenzym = Holoenzym
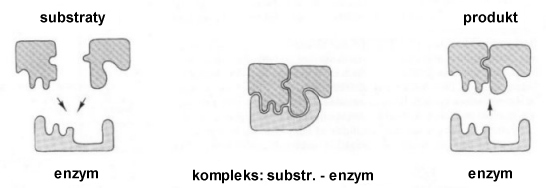
W czasie katalizy substrat wiąże się z enzymem w jego centrum aktywnym tworząc kompleks enzym-substrat. Możemy to porównać do działania suwaka błyskawicznego:
E + Substraty ES E + Produkt
Miejsce aktywne - to obszar enzymu w którym wiązany jest substrat. Substrat musi mieć odpowiedni kształt, aby mógł dopasować się do enzymu. Szczeliny i zagłębienia zwykle zawierają grupy polarne.
Wiązania występujące w kompleksie enzym-substrat:
Oddziaływania elektrostatyczne
Wiązania wodoroweSiły van der Waalsa
Oddiaływania hydrofobowe
Wiązania kowalencyjne
Na działalność enzymów wpływa:
temperatura
pH
stężenie substratu
stężenie enzymu
promienie gamma
obecność aktywatorów
obecność inhibitorów
Temperatura
Prawo Van't Hoffa: „Jeśli podwyższymy temp. O 100C, szybkość reakcji wzrośnie 2-3 razy”.
Aktywność enzymów zależy od temp. komórek w których występują
Enzymy ludzi działają tylko do 450C - gdyż wyższa temperatura ścina białko enzymu.
Optymalna temperatura dla większości enzymów zwierzęcych wynosi ok. 370C.
Optymalna temperatura dla większości enzymów roślinnych wynosi ok. 20-300C.
UWAGA! Część enzymów bakteryjnych wyjątkowo pozostaje aktywnych w temp. > 1000C (żyjące na dnie ocenau lub w gorących źródłach)
pH
Zmiany pH powodują zmiany stopnia dysocjacji grup NH2 i COOH w resztach aminokwasowych (w końcu to białka), co może powodować obniżenie aktywności enzymu.
Dla większości enzymów optymalne pH wynosi ok. 7,4 (odczyn obojętny).
Są też enzymy działające w skrajnych pH, np.:
Pepsyna (pH = 2)
Arginaza (pH = 10)
Trypsyna (pH = 8)
Do zmian pH środowiska reakcji wprowadza się bufory.
Stężenie substratu i enzymu
Wpływ ten opisuje równanie Michaelisa-Menten:
|
V - szybkość reakcji Vmax - szybkość maksymalna Km - stała Michaelisa [S] - stężenie substratu
|
Stała Michaelisa (Km) - stężenie substratu, przy którym szybkość reakcji enzymatycznej jest równa połowie maksymalnej szybkości tej reakcji (V=0,5 * Vmax). Jest miara powinowactwa enzymu do substratu. Im jest ona wyższa, tym niższe powinowactwo enzymu do substratu . Nie zależy ona od stężenia enzymu.
Szybkość reakcji
|
V - szybkość reakcji c - zmiana stężenia t - czas reakcji
|
W kompleksie enzym-substrat mogą występować wiązania:
Hydrofobowe
Kowalencyjne
Jon-dipol
Wodorowe
Jonowe
Siły van der Waals'a
Oddziaływania elektrostatyczne
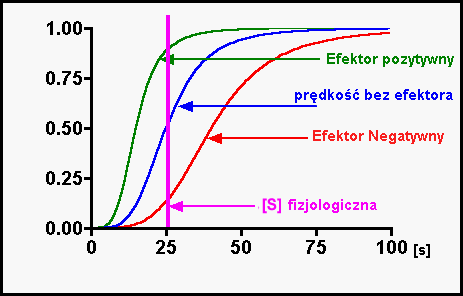
Wpływ aktywatorów i inhibitorów
Efektory = Aktywatory lub Inhibitory
Aktywatory to np.:
jony metali Mn2+, Cu2+, Mg2+, Co2+, Zn2+, Cl-, Ca2+, Fe2+/3+, K+, Na+
związki wielkocząsteczkowe o char. białkowym - działają przez odblokowanie miejsc aktywnych enzymów
małocząsteczkowe związki organiczne - usuwają wpływ substancji hamujących (cysteina, zredukowany glutation)
Inhibitory - to związki spowolniające reakcje. Wyróżniamy inhibitory:
specyficzne (uszkadzające strukturę białka enzymu) - np. jodoacetamid, Ag+, Hg+,
niespecyficzne (łączą się z enzymem odwracalnie)
kompetencyjne (współzawodniczące) - substrat i inhibitor współzawodniczą o centrum aktywne.
Przypomina on więc budową substrat.Obniża on powinowactwo enzymu do substratu
Nie wpływa na Vmax
Nie wpływa na Km.
Można cofnąć jego działanie przez zwiększenie stęż. substratu.
niekompetycyjne - łączenie się inhibitora z enzymem w innym miejscu niż centrum aktywne. Zmienia to kształt enzymu, i substrat nie ma jak się do niego przyłączyć. Mogą spowolnić reakcję, ale nie zatrzymać. Są to np.: jodoacetamid, związki arsenu, kationy met. ciężkich
Zmniejsza Vmax
Nie wpływa na Km
Nie można cofnąć jego działanie przez zwiększenie stęż. substratu.
Allosteryczne - polegają na zmianie powinowactwa do małych cząsteczek przez zmianę struktury przestrzennej. Mają wpływ na Vmax reakcji. Stała Michealisa maleje. Osiągnięcie Vmax wymaga wyższego stężenia substratu.
Efekt allosteryczny - łączenie ligandu z centrum allosterycznym enzymu.
Działanie efektora allosterycznego można zahamować dużym stężeniem substratu.
Klasycznym przypadkiem hamowania kompetycyjnego jest para malonian (I) i bursztynian (S) w stos. do dehydrogenazy bursztynianowej (Enz). Jeśli powstanie kompleks EnzI to jedyne co może zrobić to rozpaść się z powrotem na Enz i I. Wzór malonianu: -OOC-CH2-COO-
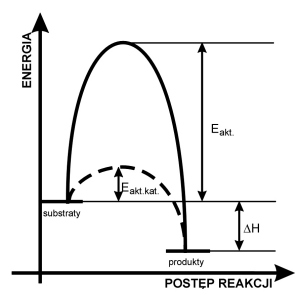
Energia aktywacji
Jest to wielkość bariery energetycznej, którą musi pokonać układ reagentów, aby doszło do reakcji chemicznej.
Jednostka aktywności enzymu = 1mikromol (1μ mol; 10-6 mol) przekształconego produktu na minutę - jednostka pomocna do określania np. ile jest enzymu w danej próbce tkankowej.
1 Katal = aktywność enzymu przekształcającego 1 mol substratu w ciągu sekundy (1mol/s) w temp. 300, w
optymalnym pH w warunkach reakcji zerowego rzedu (przy pelnym wysyceniu enzymu substratem.
Rzędowość reakcji enzymatycznej
Reakcja zerowego rzędu - stan wysycenia, wzrost stężenia substratu nie wpływa na prędkość reakcji.
Reakcja pierwszego rzędu - reakcja jednosubstratowa, której prędkość rośnie proporcjonalnie do wzrostu stężenia substratu.
Reakcja drugiego rzędu - reakcja dwusubstratowa, prędkość jest proporcjonalna do iloczynu stężeń obydwu substratów.
Reakcja trzeciego rzędu - reakcja trój substratowa, prędkość jest proporcjonalna do iloczynu stężeń trzech substratów.
Klasy enzymów wg klasyfikacji międzynarodowej:
Enzymy dzielą się na 6 klas, a każda z nich ma 4-13 podklas.
Oksydoreduktazy - przenoszą ładunki (elektrony i jony H3O+ - protony) z cząsteczki substratu na cząsteczkę akceptora: AH2 + B → A + BH2;
Oksydazy - utleniają substraty przy udziale tlenu. Katalizują przenoszenie wodoru na tlen (powstaje woda lub nadtlenek wodoru)
AH2 + ½ O2 → A + H2O
AH2 + O2 → A + H2O2Oksygenazy - katalizują proces wbudowania O2 w cząsteczkę
Hydroksylazy
Hydroperoksydazy - zalicza się tu peroksydazy i katalazę
Peroksydazy - katalizują utlenianie H2O2 różnych substratów 2 H2O2 + AH2 → 2H2O + A
Katalaza - rozkłada nadtlenek wodoru
Dehydrogenazy - odczepiają atomy wodoru, ich koenzymy to NAD, NADP, FAD, lipinian.
2AH2 + O2 → 2A + 2H2O
Koenzymy: NAD+, NADP+, FAD, FMN, koenzym Q, kwas liponowy,
Transferazy - przenoszą daną grupę funkcyjną (tiolową SH2, aminową, itp.) z cząsteczki jednej substancji na cząsteczkę innej substancji: AB + C → A + BC;
fosforylazy
kinazy
aminotransferazy (EC 2.6.1)
acylotransferazy
glukozylotransferazy
fosfotransferazy
Koenzymy: kwas liponowy, ATP, DTP (difosforan tiaminy),
Hydrolazy - powodują rozpad substratu pod wpływem wody (hydroliza); do grupy tej należy wiele enzymów trawiennych: AB + H2O → A + B; NIE MAJĄ KOENZYMÓW!
proteazy- rozkładają białka
amylazy - rozkładają skrobię
lipazy - rozkładają tłuszcze
Inwertaza - rozszczepia wiązanie β-glikozydowe sacharozy
nukleazy - rozkładają kwasy nukleinowe
fosfatazy - katalizuje hydrolizy różnych estrów fosforanowych.
Liazy - powodują rozpad substratu bez hydrolizy: AB → A + B;
Hydratazy
Hydroliazy
Dehydratazy - liazy wiązań C-O
Dekarboksylazy - liazy wiązań C-C
Koenzymy: kwas liponowy, koenzym A (CoA), fosfopirydoksal, difosfotiamina (DTP).
Izomerazy - zmieniają wzajemne położenie grup chemicznych bez rozkładu szkieletu związku: AB → BA;
Izomerazy
Mutazy
Ligazy (syntetazy) - powodują syntezę różnych cząsteczek; powstają wiązania chemiczne: A + B → AB;
wykorzystują ATP jako źródło energiiKarboksylaza - przyspieszają powstawanie wiązań C-C
Klasyfikacja enzymów przydziela im numer EC (ang. Enzyme Commission) czyli numer, jaki nadała im komisja enzymatyczna. (Jest więc on istotny!!!)
Oksydoreduktazy - wykorzystują NADPH jako subs. Redukującą, a NAD+ jak subs. utleniającą.
Znaczenie biomedyczne enzymów
Enzymy katalizują procesy niezbędne do życia
Rozkład pokarmu w celu uzyskania energii
Ogromne znaczenie diagnostyczne (AspAT, ALAT, amylaza) [amylaza - enzym rozkładający skrobię - wzrasta u chorych na zapalenie trzustki]
Koenzymy
Reakcje lityczne łącznie z reakcjami hydrolitycznymi nie wymagają koenzymów.
Koenzym może być rozpatrywany jako drugi substrat, ponieważ:
chemiczne zmiany zachodzące w koenzymie dokładnie równoważą zmiany w substracie
(np. w reakcjach oksydacyjno-redukcyjnych, gdy jedna cząsteczka substratu utlenia się, jedna cząsteczka substratu ulega redukcji)reakcja z udziałem koenzymu może mieć większe podstawowe znaczenie fizjologiczne
Koenzymy działają jako przenośniki określonych grup funkcyjnych:
D - G + A = A - G + D
Klasyfikacja koenzymów
Koenzymy przenoszące H:
NAD+ , NADP+
FMN, FAD
Kwas liponowy
Koenzym Q
Koenzymy przenoszące grupy inne niż H:
Fosforany cukrów
Koenzym A (CoA)
Pirofosforan Tiaminy
Fosforan pirydoksalu (PAL lub PLP)
Koenzymyfolianowe
Biotyna
Koenzymy kobamidowe (B12)
Kwas liponowy
Koenzymy oksydoreduktaz:
NAD+
NADP+
FAD (w skład wchodzi witamina: ryboflawina)
Koenzymy dekarboksylaz:
FAD, NAD+
kwas liponowy
Koenzym A
Fosfopirydoksal
Difosfotiamina
Przykłady Koenzymów
FADH - przenośnik wodoru
FMN -
NADH - to zredukowany NAD+
NADH i NADPH -przenośnik wodorku
Koenzym A - przenośnik grup acylowych (reszt kwasowych), zbud. z 3 składników:
ADP
Kw. pantotenowy
cysteamina
Folian - przenośnik grup metylowych
S-adenozylometionina (SAM) - przen. grup metylowych
Biotyna - wiąże CO2, wykorzystywana w reakcjach karboksylacji
Pirofosforan tiaminy - poch. Wit. B1
Pirofosforan pirodoksalu - poch. Wit. B6
Tetrahydrofolian - poch. kw. foliowego
FAD - pochodna wit. B2
ATP - Adenozynotrifosforan
NADP - fosforan dinukleotydu nikotyamidoadeninowego
NAD - Dinukleotyd nikotynamidoadeninowy
FAD - Dinukleotyd flawinoadeninowy
FMN - Flawinomononukleotyd
Izoenzymy - (Izozymy) różne odmiany jednego enzymu, powstające przy udziale różnych genów strukturalnych i mające zasadniczo taką samą budowę i mechanizm katalityczny. Różnią się sposobem ich regulowania.
np.: dehydrogenazy jabłczanowe pochodzącej z rożnych źródeł (np. wątroby szczura i Escherichia Coli) - chociaż obie te dehydrogenazy jabłczanowe katalizują taką samą reakcję ich właściwości fizyczne i chemiczne znacznie się różnią.
I Prawo Termodynamiki
Energia danego układu izolowanego jest stała (niezależnie od przemian i zmian postaci energii wewnątrz układu)
ENTALPIA (H) - (zawartość ciepła) wyraża się wzorem: H = U + p * V
U - energia wewnętrzna,
p - ciśnienie,
V - objętość
II Prawo Termodynamiki
W układach izolowanych przemiany samorzutne są nieodwracalne i związane ze wzrostem entropii.
ENTROPIA - kierunek przebiegu procesów spontanicznych (samorzutnych) w odosobnionym układzie termodynamicznym (im entropia wyższa tym większe nieuporządkowanie)
Fosforylacja
Fosforylacja to proces endoenergetyczny polegający na przyłączeniu do białka reszty fosforanowej, przeprowadzany przez enzymy zwane kinazami, zużywające energię zgromadzoną w ATP.
kinaza ATP + białko -> białko-fosforan + ADP
Inaczej również można powiedzieć, że jest to proces przyłączenia reszty kwasu ortofosforowego określonych związków chemicznych, zachodzi w organizmach żywych. Jest katalizowany przez enzymy zwane fosfotransferazami (kinazy), które transportują reszty kwasowe na białka, nukleotydy, cukry oraz lipidy. Związki, którym dostarczone zostają reszty fosforanowe, uzyskują wyższy poziom energetyczny. Niezwykle istotną reakcją dla organizmów żywych jest fosforylacja kwasu ADP (włączenie reszty kwasu fosforowego przez ADP), dzięki której dochodzi do wytworzenia ATP, co ma wielkie znaczenie dla regulacji gospodarki energetycznej w komórkach.
Wyróżniamy fosforylację:
fotosyntetyczną
oksydacyjną
substratową
Klasa |
Reakcja |
|
Oksydoreduktazy |
AH2 + B → A + BH2 |
|
Transferazy |
AB + C → A + BC |
|
Hydrolazy |
AB + H2O → A + B |
|
Liazy |
AB → A + B |
|
Izomerazy |
AB → BA |
|
Ligazy |
A + B → AB |
|
Oddychanie komórkowe
Tlenowe oddychanie komórkowe składa się z 3 etapów:
Glikoliza (w Cytosolu)
Reakcja Pomostowa (w Matrix mitochondrialnym)
Cykl Krebsa (w Matrix mitochondrialnym)
Wyszukiwarka
Podobne podstrony:
wyroby medyczne opieka farmaceutyczna
enzymy
Seminarium 6 Immunologia transplantacyjna farmacja 2
BLS farmacja
pros 4 Enzymy 1
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
Inspekcja farmaceutyczna ppt
TECHNIK FARMACJI (2)
kol enzymy
Dla studentow I Roku Farmacji
enzymy
Farmacja cw 1 2012
Fitoterapia schorzeń reumatycznych, Farmacja, Farmakognozja
EGZAMIN - maści, Technik Farmaceutyczny
Układ limfatyczny, farmacja, Farmakologia
więcej podobnych podstron