CHEMIA*
Wykład 1. 28.09.2008
Wykrywanie kwasów i zasad.
Układ okresowy.
Pierwszy układ okresowy Mendelejewa.
Mendelejew wziął przy próbach klasyfikacji pierwiastków pod uwagę masy i właściwości pierwiastków. Rozpisał je w szereg a następnie te o zbliżonych właściwościach pisał w pionowych kolumnach. W ten sposób powstał pierwszy układ okresowy.
Poziome szeregi noszą nazwę okresów, pionowe kolumny nazywane są grupami. Pierwiastki należące do tej samej grupy mają analogiczną konfigurację zewnętrznych powłok elektronowych, wykazują wiele podobieństw we własnościach fizykochemicznych.
Wartościowość pierwiastków
Wartościowość to liczba wiązań, którą tworzy atom danego pierwiastka w cząsteczce związku chemicznego. Oznacza się ją liczbą rzymską. Tlen w związkach ma wartościowość II, wodór w związkach ma wartościowość I. Przy budowaniu wzoru sumarycznego można z reguły zastosować metodę krzyżową (należy pamiętać o skracaniu liczb, które mają wspólny podzielnik):
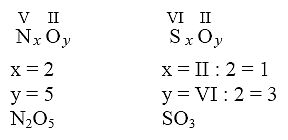
Jak zmienia się elektroujemność?
Grupa |
I II III IV V VI VII |
Określoność |
|
1 2 3 4 5 6 7 |
|
zmniejszenie się elektroujemności
wzrost elektroujemności
Forma długa bierze pod uwagę kolejność zapełniania orbit elektronami.
Materia:
wszystko co nas otacza
badania zmysłami i aparaturą
mieszanina różnych materii.
Substancja:
materia
określone właściwości chemiczne i fizyczne
określone wzory chemiczne
podział na:
proste
zbudowane z atomów 1 pierwiastka
złożone
związki chemiczne zbudowane z atomów 2 pierwiastków.
Pierwiastek:
zbiór atomów
ta sama liczba protonów w jądrze atomowym.
Atom:
najmniejsza ilość pierwiastka
mikrostruktura elektrycznie obojętna
dodatnio naładowane jądro otoczone eletronomi.
Budowa atomu:
Proton - ciężka cząstka elementarna, o dodatnim ładunku elektrycznym i masie 1,6726*10-27kg; składnik jądra atomowego.
Elektron - trwała cząstka elementarna o ujemnym ładunku elektrycznym 1,602*10-19C i masie spoczynkowej 9,109*10-31kg, jeden z podstawowych składników atomu, które krążą wokół jądra wytwarzając wokół chmurę elektronową.
Neutron - ciężka, elektrycznie obojętna cząstka elementarna o masie 1,6748*10-27kg; składnik jądra atomowego; swobodny - nietrwały, rozpada się na proton z emisją negatonu i antyneutrina.
Jądro atomowe - centralna część atomu skupiająca całą jego masę, złożone z nukleonów powiązanych siłami, stanowi układ nietrwały ulegający rozpadowi promieniotwórczemu;
Liczba atomowa to liczba protonów w jądrze atomowym.
Liczba masowa to liczba nukleonów, czyli suma protonów i neutronów w jądrze atomowym.
Izotopy - atomy tego samego pierwiastka o różnej liczbie masowej, np.![]()
Izotony - atomy różnych pierwiastków o takiej samej liczbie neutronów, lecz różnej liczbie masowej, np.![]()
Izobary - atomy różnych pierwiastków o tej samej liczbie masowej, np.![]()
Atomowa jednostka masy:
u (unit),
dalton (d)
jednostka węglowa,
to 1/12 masy obojętnego atomu nuklidu węgla 12C.
1 u = 1,66 * 10-24g = 1,66 * 10-27kg
Cząsteczka:
najmniejsza ilość substancji prostej lub złożonej
posiada właściwości tej substancji.
Masa atomowa to liczba wskazująca, ile razy masa atomu danego pierwiastka jest większa od atomowej jednostki masy (u).
Masa cząsteczkowa to liczba wskazująca, ile razy masa cząsteczki danej substancji jest większa od atomowej jednostki masy (u).
Masę cząsteczkową obliczamy, sumując masy atomowe atomów danej cząsteczki.
Mol to:
jednostka liczności materii
ilość substancji zawierająca taką samą liczbę cząstek jaka jest w masie nuklidu.
Masa molowa to :
masa mola atomów
lub innych cząsteczek
wyrażona w gramach.
Prawo Lavoisiera i Łomonosowa
Prawo zachowania masy.
Masa substratów równa jest masie produktów reakcji.
Prawo zachowania energii Janle
Energia w układzie jest stała.
Prawo prostych stosunków objętościowych Gay - Lussaca
Objętości reagujących gazów i gazowych produktów reakcji, odmierzone w tych samych warunkach fizycznych, pozostają do siebie w stosunku niewielkich liczb całkowitych.
Prawo Avogadra
Jednakowe objętości różnych gazów w tych samych warunkach temeratury i ciśnienia zawierają tę samą liczbę cząsteczek.
Warunki normalne T= 273oK , 0oC, ciśnienie = 1013hPA wynosi 22,4 dm3
Równanie stanu gazu doskonałego
PV = n RT
n
n = M
Cząstki elementarne
najmniejsze cząstki z których zbudowane są atomy wszystkich pierwiastków. Jedne cząstki wchodzą w skład atomu inne powstają w trakcie oddziaływania atomu i przemian w nich.
Najważniejsze cząstki elementarne:
0
elektron 1 e posiada jednostkowy ładunek elektryczny
1
proton 1 p masa 1836 razy większa od masy elektronu jednostkowy ładunek dodatni
0
neutron 1 n masa równa sumie mas protonu i elektronu, nie posiada ładunku
proton + elektron = neutron
Antycząstki
0
pozyton (elektron) 1e masa równa się masie elektronu, ładunek jednostkowy dodatni
1
antyproton -1p masa równa się masie protonu, ładunek jednostkowy ujemny
1
antyneutron 0 n różni się od neutronu zwrotem wektora momentu obrotowego i magnetycznego
mezony masy 200 - 300 mas elektronu.
Modele budowy atomu
Rutherford - planetarny model atomu
Nils Bohr - model atomu
Wymiary energii kwantami
E = h * v
h = 6,625 * 10-34
Stała Plancka
J * s E2 - E1 = h * v
v - częstotliwość drgań
Dualizm korpuskularno - falowy de Brogue
Planck
E = h * v
Einstein
E = mc2
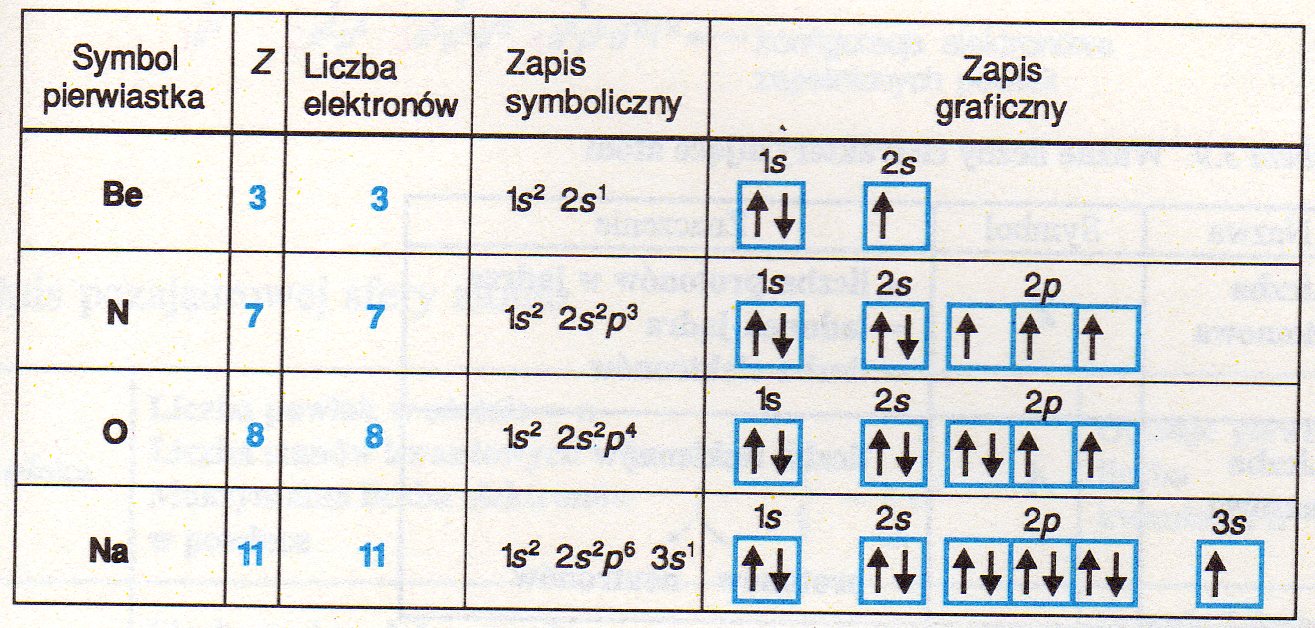
Liczby kwantowe
opisują stan energetyczny
położenie elektronów w atomie.
Są one wynikiem rozwiązania równania Trynigöra. Jest to równanie różniczkowe, jego rozwiązaniem nie są liczby lecz funkcje. Absolutna wartość funkcji falowej (psi)Ψ2 = 0 przedstawia prawdopodobieństwo występowania elektronów w przestrzeni otaczającej jądro.
Ψ2 = 0 określa kształt orbitalu ( kontur orbitalu).
Elektron zajmuje odpowiedni orbital elektronowy - przestrzeń nie orbitę czyli tor.
Wielkości związane z energią i innymi stanami kwantowymi elektronów oznacza się liczbami kwantowymi.
Główna liczba kwantowa n określa stan energetyczny elektronów w atomie wynikający z odległości elektronu od jądra.
Przyjmuje ona wartości liczb naturalnych:
n = 1, 2, 3, 4, .... ∞
Główna liczba kwantowa decyduje o rozmiarach orbitalu (wielkości), poboczna liczba kwantowa l przyjmuje wartości n -1 liczb całkowitych od 0 do liczby o 1 mniejszej od wartości głównej liczby kwantowej (0 do n-1). Jej wartość określa kształt orbitalu s p d f.

Magnetyczna liczba kwantowa przyjmuje wartości wszystkich liczb całkowitych łącznie z 0 w zakresie od -l do +l
Magnetyczna spinowa liczba kwantowa dotyczy własnego momentu pędu elektronu i posiada ![]()
tylko wartość![]()
Zakaz Pauliego
mówi , że w jednym atomie dwa elektrony muszą różnić się wartością przynajmniej jednej liczby kwantowej (np. w jednym poziomie orbitalnym muszą mieć przeciwną orientację spinu).
Reguła Hunda mówi, że:
liczba niesparowanych elektronów w danej podpowłoce powinna być możliwie jak największa
1s < 2s < 2p < 3s < 3p < 4f = 3d < 4p
1
W1*
Wyszukiwarka
Podobne podstrony:
Wykad 4 WD, Chemia
Wykad 3 WD, Chemia
Wykad 2 WD, Chemia
wykad 5 dWD, Chemia
Chemia fizyczna - wykad 5, OŚ, sem II 1 SOWiG, Chemia Fizyczna
Chemia kliniczna wykad VIII) 11
chemia kliniczna-wykad 2, BIO, Diagnostyka Laboratoryjna, chemia kliniczna, semestr V
Wykad 6, Chemia
Chemia kliniczna-wykad IX 10.12, BIO, Diagnostyka Laboratoryjna, chemia kliniczna, semestr V
Chemia Bionie wyk1
chemia powt
Wykład Chemia kwantowa 11
więcej podobnych podstron