Biochemia - Wykład 1 - 24.02.2011
To dyscyplina naukowa; posiada metody i przedmiot badań.
Przedmiotem biochemii są: „przemiany chemiczne zachodzące w żywej komórce oraz w organizmie jako całości oraz towarzyszące im przemiany energetyczne związków naturalnych”.
Podstawowe przemiany chemiczne:
-synteza
- przebudowa
- rozkład
Podstawowe przemiany energetyczne:
- pobieranie energii ze środowiska
- przetwarzanie energii
-magazynowanie energii
- użytkowanie energii (w procesach życiowych)
Poznanie żywego obiektu jest tylko prawdopodobne, istnieją stopnie przybliżonego poznania:
I przybliżenie - najgrubsze - to poziom anatomii, funkcjonalnie odpowiada mu fizjologia
II przybliżenie - poziom komórkowy i odpowiadająca mu funkcjonalnie biochemia
III przybliżenie - to anatomia molekularna z funkcjonalnym odpowiednikiem konformacji
IV przybliżenie - najdokładniejsze - to poziom submolekularny z odpowiadającym mu niechemicznym behawiorem kwantowym w postaci ruchu elektronów, produkcji fotonów i fononów (bioelektronika, Sedlak)
Biochemia jako nauka:
- klasyfikacja historyczna :
*biochemia statyczna (opisowa) - chemia związków naturalnych
*biochemia dynamiczna - opisuje procesy metaboliczne i towarzyszące im efekty energetyczne, podstawowe dla funkcjonowania każdej żywej komórki i organizmu jako całości
- biochemie funkcjonalne: mikroorganizmów, roślin, zwierząt, człowiekaspecyficzne aspekty i problemy
- związek z innymi dyscyplinami wiedzy: biochemia medyczna (historycznie pierwsza), biochemia żywienia, biochemia żywności
Biochemia żywności to nauka:
Opis składu chemicznego i procesów chemicznych zachodzących :
-w produktach naturalnych(surowcach)specyfika przemysłu spożywczego
- podczas procesów technologicznych
- podczas składowania wyrobów gotowych
Znajomość składu chemicznego i możliwość przewidywania reakcji chemicznych pozwala na:
-określenie sposobów i warunków przechowywania(konserwowania, utrwalania-hamowanie metabolizmu mikroorganizmów, reakcji chemicznych) surowców, półproduktów i produktów
- sterowanie procesami enzymatycznymi w technologiach opartych o działanie rodzimych enzymów( np. słodowanie, warzenie piwa, dojrzewanie serów)
-opracowywanie nowych technologii z udziałem egzogennych preparatów enzymatycznych (skrobia, aspartam- słodzik)
- kierowanie procesami technologicznymi wykorzystującymi działalność żywych mikroorganizmów(fermentacja alkoholowa, synteza biomasy drożdżowej, witamin, aminokwasów, antybiotyków)
Skład pierwiastków żywej materiiselektywny dobór pierwiastka
Spośród około 100 pierwiastków litosfery tylko 22 stanowią niezbędne składniki żywych organizmów, w tym 16 występuje we wszystkich organizmach.
99% masy większości komórek stanowią: C, O, H, N, S, P; jony jednoatomowe: Na+, K+, Mg2+, Ca2+, Cl-; mikroelementy: Mn, Fe, Co, Cu, Zn, B, Al., V, Mo, I, Si-dla niektórych organizmów.
Względny udział niektórych pierwiastków chemicznych w składzie skorupy ziemskiej i w składzie ciała człowieka:
pierwiastek |
skorupa |
Ciało człowieka |
|
Ilość atomów(%) |
|
C |
0,08 |
10,5 |
O |
625 |
25,5 |
H |
- |
60,3 |
N |
0,001 |
2,42 |
S |
- |
0,132 |
P |
1,42 |
0,134 |
Si |
21,2 |
- |
Al |
6,47 |
- |
Na |
2,64 |
0,73 |
Ca |
1,94 |
0,226 |
Fe |
1,92 |
- |
Mg |
1,84 |
- |
Dlaczego w organizmach żywych obserwujemy podwyższoną zawartość C, H, N, S?
Dlaczego węgiel:
- 4 elektrony na powłoce walencyjnej węgla mogą uczestniczyć w tworzeniu 4 silnych wiązań kowalencyjnych
- wiązania mogą być tworzone pomiędzy atomami węgla dając łańcuchy proste, rozgałęzione lub mogą tworzyć formy pierścieniowe
- atom węgla może się łączyć z : H, O, N, S, P
- C-łatwość tworzenia bardzo silnych wiązań kowalencyjnych
- tetraedryczna struktura związków węgla, np. w metanie
Wiązania Si-Si są nietrwałe polimery krzemu są nierozpuszczalne w wodzie. Krzem ma właściwości zbliżone do węgla. Na bazie krzemu myślano, że można utworzyć alternatywne związki organiczne.
Dlaczego wodór:
W żywym organizmie występują związki w wysokim stopniu zredukowane, tzn. bogate w energię (stąd podwyższona zawartość H), która jest konieczna do życia.
CO2, N2O5, SO2- atomy utlenione
CH4, NH3, H2S zredukowane
Funkcje soli mineralnych:
- strukturalna( P, Ca: budowa kośćca)
- osmotyczna i buforująca(sole mineralne)
- biochemiczne(kofaktory)
* P(ser, jaja, zboża): strukturalna, energetyczna, genetyczna, fotosynteza, buforująca PO43-
*S(mięso, jaja, kapusta): składnik aminokwasów, układy redox, kofaktory, witaminy, -SH - reszta tiolowa, najbardziej popularna forma w jakiej spotkamy siarkę
*Ca(mleko i jego przetwory): strukturalna, katalityczna, Ca2+, skurcz + rozkurcz mięśni
*Mg(rośliny zielone, ziarna kakao): strukturalna, kofaktor, Mg2+
*Fe(mięso, rośliny): hemowe (poch. zwierzęcego) niehemowe(poch. roślinnego), redox, utlenianie biologiczne
WODA(monotlenek diwodoru)
- zawartość w tkankach 70-98%, w tkankach podporowych mniej
- rozpuszczalnik związków jonowych i polarnych, środowisko reakcyjne
-związki hydrofilowe
- związki hydrofobowe
- wymiana cieplna, transport
- dipol wody (asymetryczne rozmieszczenie ładunków). Każdy związek, który nie ma w swojej budowie obszarów zjonizowanych ani spolaryzowanych reszt to związek hydrofobowy (na odwrót - hydrofilowy)
- cząsteczki wody tworzą między sobą 4 wiązania wodorowe(potrzeba dużo ciepła by pokonać te wiązania stąd temperatura wrzenia 100 st.C; dobry bufor temperaturowy)
- polarność wody decyduje o tym, że jest znakomitym rozpuszczalnikiem oraz o jej reaktywności H+/OH-
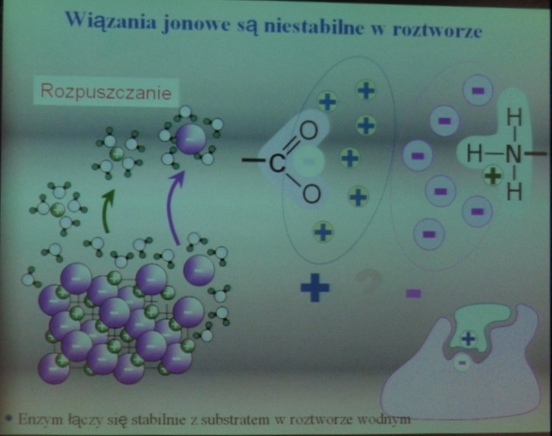
- wiązania jonowe są niestabilne w roztworze
„ To nie jest czapeczka siostry miłosierdzia.”
Jest to symbol aktywnego biokatalizatora o budowie białkowej. Dziura to centrum aktywne enzymu. Z obszaru centrum aktywnego enzymu w czasie katalizy woda jest usuwana.
Wiązania wodorowe

- liniowość ważna dla siły wiązania
Energia wiązań chemicznych:
- siły Van der Waalsa - 0,1 kcal/mol
- hydrofobowe - 1 kcal/mol
- wodorowe - 1 kcal/mol
- jonowe 3 kcal/mol
-kowalencyjne - 90kcal/mol
Energia niektórych wiązań w roztworze wodnym zmienia się :
wiązanie |
długość |
w próżni |
Roztwór |
Kowalencyjne |
0,15nm |
90kcal/mol |
90kcal/mol |
Jonowe |
0,25nm |
80kcal/mol |
3kcal/mol |
Wodorowe |
0,3nm |
4kcal/mol |
1kcal/mol |
Siły V.der Waalsa |
0,35nm |
0,1kcal/mol |
0,1kcal/mol |
Oddziaływania między różnoimiennymi jonami w centru aktywnym mogą być silne, dzięki usunięciu z niego wody.
Cząsteczki z podobną polarnością oddziałują na siebie
Podobny rozpuszcza podobny
Polarnypolarny
Niepolarnyniepolarny
Schematyczny model cząsteczki białka(lub jak to Prof. Żyła uważa łańcuch lampek choinkowych :P)
Aktywność wody(aw)
Roztwór wodny różni się od czystej wody mniejszą prężnością pary wodnej. Stopień obniżenia prężności pary wodnej wyraża prawo Raulta:
=
p - prężność par roztworu,p0 -prężność par rozpuszcz
n1 -stężenie molowe subst rozpuszcznej
n2 - stężenie molowe rozpuszczalnika
aw=
=
aw=1,0( dla czystej wody); =0,0(gdy brak wody w środowisku)
zależność pomiędzy zawartością a aktywnością wody wpływ aw na:
Rozwój mikroflory: bakterie aw 0,9-0,98, drożdże: aw>0,85, pleśnie aw>0,75
Reakcje enzymatyczne: lipaza aw>0,1; inne aw>0,85
Reakcje brązowienia nieenzymatycznego(Maillarda), maksimum szybkości przy aw 0,6-0,7
Reakcje utlenienia
Modyfikacje aktywności wody w technologii żywności:
- suszenie
-zamrażanie(liofilizacja)
- dodawanie substancji zmniejszających aktywność wody: glukoza, sacharoza, NaCl, białka soi, kazeina, sorbitol, glicerol, glikol propylenowy.
Funkcje związków organicznych:
Dwie kategorie substancji:
Związki specyficzne(informacyjne) - kolejności koralików w łańcuchu nie są przypadkowe. Są to długołańcuchowe, wielocząsteczkowe biopolimery
- białka - funkcje katalityczne, strukturalne, regulacyjne
- kwasy nukleinowe
*DNA
*RNA(mRNA, tRNA, rRNA)
2. Związki niespecyficzne(zw zapasowe, metabolity pośrednie) - nie przenoszą żadnych informacji
- aminokwasy, nukleotydy, monosacharydy i ich pochodne fosforanowe, kwasy tłuszczowe)
- prekursory, np. kwasy organiczne
- polisacharydy i lipidy
- związki makroergiczne
-barwniki roślinne i zwierzęce(hem, chlorofil, karotenowce)
- koenzymy
- witaminy
Hierarchiczna organizacja żywej materii
Biomolekuły pierwotne (16 aminokwasów, 5 aromatycznych zasad azotowych, 1 kwas tłuszczowy, 2 cukry proste, 1alkohol-glicerol, 1 amina-cholina)
Makromolekuły (białka-funkcje, kwasy nukleinowe, cukrowce złożone, tłuszczowce)
Zestawy supramolekularne (kompleksy enzymowe, układy kurczliwe, błony)
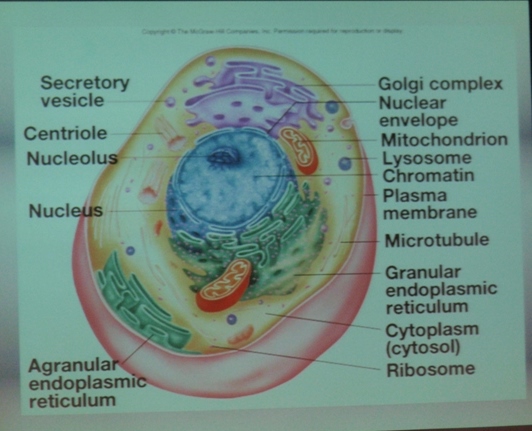
Organelle (jądro, mitochondria,chloroplasty itd.) obserwowane pod mikroskopem elektronowym.
Komórka
Wyszukiwarka
Podobne podstrony:
Biochemia 13, TŻ UR, II rok, Biochemia
Biochemia 12, TŻ UR, II rok, Biochemia
Biochemia 6, TŻ UR, II rok, Biochemia
Biochemia 4, TŻ UR, II rok, Biochemia
sprawozdanie oznaczanie sacharydów, TŻ UR, II rok, Analiza i ocena jakości żywności
sprawko oznaczanie zawartości białka, TŻ UR, II rok, Analiza i ocena jakości żywności
mikrooo - egzamin, TŻ UR, II rok, Mikrobiologia żywności, Egzamin
exam z analizy pyt, TŻ UR, II rok, Analiza i ocena jakości żywności
TEST 3, TŻ UR, II rok, Analiza i ocena jakości żywności
26. Aminokwasy i peptydy, Technologia Żywnośći UR, II rok, biochemia
pytania na kolokwium, Technologia Żywnośći UR, II rok, biochemia, Biochemia (Explano88)
wszystkie pytania, Technologia Żywnośći UR, II rok, biochemia
Metody oznaczania bialek, Technologia Żywnośći UR, II rok, biochemia
Ergonomia, Technologia Żywnośći UR, II rok, ERGONOMIA
MELATONINA, II rok, II rok CM UMK, Giełdy, od Joe, biochemia, BIOCHEMIA, GIEŁDY - EGZAMIN, Dodatkowe
6 integracja metabolizmu, Płyta farmacja Poznań, II rok, biochemia
BIOCHEMIA- pojęcia, Studia, II rok, II rok, III semestr, Biochemia
więcej podobnych podstron