Zoonozy
Rezerwuar zarazka - określona populacja (ludzka, zwierzęca, roślinna) lub środowisko, w których wykrywa się stale występowanie określonych drobnoustrojów chorobotwórczych
Czynniki etiologiczne zoonoz
Bakterie
Wirusy
Priony
Pasożyty
Bakteryjne
Gram dodatnie laseczki
- wąglik Bacillus antracis
Gram dodatnie pałeczki
- listerioza Listeria monocytogenes
- nosacizna Burholderia maleii
- różyca Erisiphelothrix rhusiopathie
Krętki
- borelioza Borelia spp.
- leptospirozy Leptospira interrogans
Mycobacterie
- gruźlica odzwierzęca M.bovis
- mykobacteriozy Mycobacterium spp.
Gram ujemne pałeczki
choroba kociego pazura Bartonella henselae
- dżuma Yersinia pestis
- bruceloza Brucelloza spp.
- tularemia Francisella tularensis
- salmonelozy Salmonella spp.
- kolibakterizy Escherichia coli
- jersinioza Yersinia spp.
Riketsje
- Anaplazmoza granulocytarna
Chlamydie
- papuzica Chlamydia psitacii
Wirusowe
Wścieklina
kleszczowe zapalenie mózgu rodzina
limfocytarne zapalenie opon mózgowo-rdzeniowych i splotów naczyniówkowych
gorączka krwotoczna z zespołem nerkowym
Gorączka piaskowa
Pryszczyca
Ospa krowia
Guzki dojarek
Gorączki krwotoczne
świńska grypa - wirus grypy
ptasia grypa
Wścieklizna jest ostrą wirusową infekcją ośrodkowego układu nerwowego, występującą
u zwierząt lądowych (w tym również u ludzi) oraz nietoperzy. Typowe objawy kliniczne
choroby obejmują zmiany w zachowaniu (agresja) i postępujący paraliż prowadzący do
śmierci.
Czynnikiem wywołującym chorobę jest neurotropowy wirus wścieklizny należący do rodziny Rhabdoviridae i rodzaju Lyssavirus. Wirus wścieklizny wędruje wzdłuż nerwów obwodowych z miejsca zakażenia do ośrodkowego układu nerwowego i tam się namnaża. Na kilka dni 1-10 przed wystąpieniem objawów klinicznych wirus przedostaje się do ślinianek. Okres wylęgania - czas od momentu zakażenia się do pojawienia się pierwszych objawów choroby wynosi 10 dni do 2 lat, długość tego okresu zależy od dawki zakażającej i miejsca wprowadzenia wirusa do organizmu
wirus wścieklizny jest obecny: w płynie mózgowo - rdzeniowym chorych zwierząt, w ślinie w końcowym stadium choroby
wirus wścieklizny nie występuje: we krwi, moczu, stolcu
źródło zakażenia: dzikie zwierzęta drapieżne, nietoperze, psy, koty, szczury, piżmaki, jeże, kuny, tzw „zwierzęta ofiary”: bydło, sarny itp.
nie chorują na wściekliznę: ptaki, gady, ryby
Do zakażenia wścieklizną dochodzi głównie w wyniku: pogryzienia przez chore zwierzę, przedostania się śliny chorego zwierzęcia na skaleczenia i zadrapania skóry, na błony śluzowe np. jamy ustnej, do spojówki oka
Objawy wścieklizny u człowieka: gorączka, ból głowy, zaburzenia czucia w miejscu zakażenia (pieczenie, swędzenie), wzmożona nerwowość i niepokój, pobudzenie układu współczulnego przejawiające się m.in. łzawieniem, rozszerzeniem źrenic, potliwością, wzmożonym wydzielaniem śliny, bolesne skurcze mięśni gardła i przełyku przy przełykaniu, ślinotok - z obawy przed bólem chory unika się połykania śliny, brak apetytu i wodowstręt spowodowane są bólem przy przełykaniu, trudności w oddychaniu wywołane skurczami mięśni oddechowych, napady drgawek, porażenie apatia, śpiączka, objawowe zakażenie wścieklizną kończy się zawsze śmiercią
Zakażenia układu pokarmowego
Salmonella spp.
E. coli (ECEC, ECEP, ECEH)
Yersinia enterocolitica
Campylobacter jejuni
Vibrio parahemoliticus
E. coli (ETEC)
Listeria monocytogenes
Leptospiroza
Leptospira interrogans -
Gryzonie dziko żyjące
Gatunki udomowione - świnie, bydło, pies
- Z moczem tych zwierząt zarazki dostają się do wody, którą sobie szczególnie upodobały i do gleby. Stąd poprzez śluzówki (przewód pokarmowy, oczy, nos) i uszkodzoną skórę mogą się dostać do człowieka. Istnieje także możliwość zakażenia poprzez nienaruszoną skórę, na przykład podczas chodzenia boso po podmokłym terenie
- Czas pomiędzy narażeniem na zakażenie (czyli ekspozycją) a rozwojem choroby i pojawieniem się objawów jest zmienny i wynosi od 2 dni do 4 tygodni.
Leptospiroza patogeneza i obraz kliniczny
Anhtrax wąglik
Bacillus anthracis
R. Zwierzęta roślinożerne
Postacie kliniczne
Skórna - czarna krosta - śmiertelność 20%
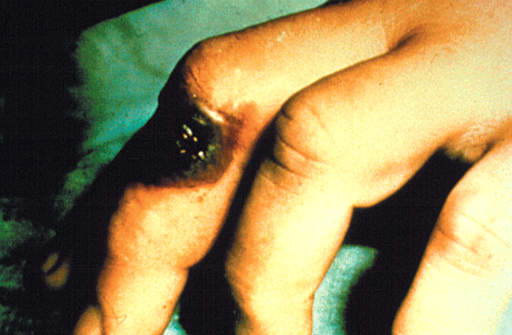
Pokarmowa - nudności, wymioty,
Biegunki krwisto-śluzowe,
wzdęcie brzucha, spadek ciśnienia - śmiertelność 50%
Inhalacyjna śmiertelność 100%
Czynniki chorobotwórczości
Polisacharydowa otoczka
Toksyna wąglikowa - antygen
ochronny PA
Czynnika śmiertelnego LF
Czynnika obrzęku EF
Profilaktyka Szczepienia ludzie zwierzęta
Anthrax-wąglik - nazwa choroby pochodzi od greckiego słowa anthrakis (węgiel), prawdopodobnie związana z obecnością czarnej śledziony stwierdzanej u padłych zwierząt. Czynnikiem chorobotwórczym jest Gram-dodatnia nieruchoma bakteria,
Bacillus anthracis posiada niezwykły antygen polisacharydowy ściany komórkowej, tworzący jednorodną antygenowo otoczkę.
Otoczka nie jest toksyczna, ale chroni bakterię przed czynnikami bakteriobójczymi, znajdującymi się w surowicy oraz fagocytozą, umożliwiając szybkie namnażanie się. Rolę patogenną odgrywa toksyna wąglikową.
Toksyna wąglikowa ma charakter termostabilnej egzotoksyny.składa się z dwóch części A i B. Cząsteczka B służy łączeniu cząsteczki aktywnej A z komórką docelową Rolę tej cząsteczki pełni tzw antygen protekcyjny ponieważ wzbudza produkcję przeciwciał Część B to czynnik letalny LF i czynnik obrzęku EF, które mogą występować pojedynczo lub razem. Czynnik EF jest podobny do działania składnika toksyny krztuścowej - cyklazy adenylowej w połączeniu z PA, powoduje wzrost cAMP we wrażliwych komórkach, wzrost przepuszczalności naczyń, spadek rezerwy ATP, jak i uszkodzenie działania miejscowych makrofagów. Czynnik LF w połączeniu z PA to zależna od Zn++ proteaza, która indukuje produkcję cytokin w makrofagach. Czynniki EF i LF zwiększają podatność na zakażenie poprzez osłabienie funkcji neutrofili i odporności zakażonego organizmu. Zjadliwość Bacillus anthracis zależy więc od 3 składników: otoczki, składników toksyny EF i LF. Czynniki wirulencji pojawiają się w odpowiedzi na bodziec pochodzący ze środowiska w postaci wzrostu CO2, który jest sygnałem, że patogen znalazł się w tkankach ssaka.
Choroby odkleszczowe
* borelioza
kleszczowe zapalenie mózgu
* tularemia
* ehrlichioza
* babeszjoza
* gorączka Q
* gorączka plamista Gór Skalistych
* dur powrotny
Powiększenie węzłów chłonnych
Tularemia
Francisella tularensis
Tularemia - gorączka zajęcza”
Rezerwuar . małe gryzonie, myszy, wiewiórki, zające i króliki,
Postacie kliniczne
- wrzodziejąco-węzłową,
- węzłową, oczno-węzłową, anginową,
- wziewną, trzewną
- i septyczną
Diagnostyka serologiczna
Riketsjozy
Grupa ostrych chorób gorączkowych
Dury wysypkowe
- epidemiczny R. prowazakii
- sporadyczny
- szczurzy R. mooserii
Gorączki plamiste
- g. Gór Skalistych R. rickettsii
- g. śródziemnomorka R. conori
- japońska gorączka plamista R. japonica
-g. wyspy Flindersa R. honei
- kleszczowa gorączka afrykańska R. africae
- riketsjoza kalifornijska R. felis
Wektor zakażeń - różne gatunki kleszczy
Inne riketsjozy
Gorączka Q Coxiella burnetii
źródłem zakażenia
- zwierzęta hodowlane
- produkty pochodzenia
zwierzęcego.
drogą zakażenia
- wziewną,
- drogą pokarmową- Spożywanie przetworów z surowego mleka i mięsa
Stały rezerwuar - kleszcze
Choroba kociego pazura
Bartonella henselae
Ehrlichioza
Ehrlichia chaffensis
Anaplazmoza
Anaplasma phagocytophilum
Riketsjoza patogeneza i obraz kliniczny
Środkowoeuropejskie kleszczowe zapalenie mózgu (wczesnoletnie kleszczowe zapalenie opon mózgowo-rdzeniowych i mózgu, odkleszczowe zapalenie mózgu - KZM
UWAGA! Według oficjalnych statystyk Narodowego Instytutu Zdrowia Publicznego-PZH w 2009 r w Polsce
zanotowano najwyższą w historii liczbę przypadków Kleszczowego Zapalenia Mózgu.
Stanowiło to ponad 70% wzrost do roku poprzedniego.
Zanotowano również przypadki na terenach, na których wcześniej ich nie notowano.
Stadia rozwojowe kleszczy
W każdym stadium rozwojowym od
larwy do
nimfy
imago kleszcze muszą przynajmniej raz wyssać krew zwierzęcia kręgowego, aby przekształcić się w kolejną formę rozwojową.
Larwa pasożytuje na żywicielu od dwóch do pięciu dni przed odpadnięciem i
przekształceniem w nimfę, która pasożytują na żywicielu przez kolejne dwa do siedmiu dni i przekształcają się w postać dorosłą (imago).
Czas trwania cyklu rozwojowego jednego pokolenia kleszczy od stadium jaja do momentu złożenia jaj przez zapłodnioną samicę jest zróżnicowany i trwa, według literatury, od sześciu miesięcy do ośmiu lat.
Kleszczowe zapalenie mózgu
Definicja
Wirusowe kleszczowe zapalenie mózgu (KZM) jest chorobą ośrodkowego układu nerwowego przenoszoną przez kleszcze Ixodes.Czynnikiem etiologicznym choroby jest wirus RNA należący do rodziny Flaviviridae.
Okres wylęgania KZM wynosi od 4 do 28 dni, średnio 7 - 14 dni, w przypadku zakażenia pokarmowego jest krótszy i trwa 3 - 4 dni.
Przenoszenieukłucia przez zakażonego kleszcza, ale choroba może szerzyć się również
drogą pokarmową przez picie surowego, niepasteryzowanego mleka (kozie, owcze, krowie) pochodzącego od zakażonych zwierząt.
Rzadziej do infekcji dochodzi drogą wziewną np. przez wdychanie kurzu zanieczyszczonego kałem kleszczy.
Kleszczowe zapalenie mózgu
W pierwszej fazie objawy przypominają infekcję grypową lub grypopodobną
temperatura do 38 stopni;
złe samopoczucie z narastającym osłabieniem;
bóle głowy i karku;
bóle mięśni kończyn, a także bóle gałek ocznych
Wiremii
druga faza choroby- neurologiczna OUN
wysoka gorączka nawet do 40°C;
silne bóle głowy;
nudności, wymioty;
objawy oponowe;
bóle stawów i mięśni.
W większości przypadków kleszczowe zapalenie mózgu przebiega łagodnie, jednak jest obarczone wystąpieniem powikłań. Wpływ na to ma wiek chorych oraz ciężkość przebiegu choroby.
Do najczęściej zaobserwowanych powikłań należy:niedowład;
trwałe uszkodzenie słuchu;
zaburzenia psychiczne
Diagnostyka KZM
wyizolowanie wirusa KZM z surowicy i płynu mózgowo-rdzeniowego (hodowla na liniach komórkowych Vero, BHK-21, PK, RH lub na mózgach mysich).
Genom wirusa może być wykazany metodą RT-PCR (reverse transcriptase polymerase chain reaction) zarówno w surowicy krwi, jak i w płynie mózgowo-rdzeniowym w ostrej fazie choroby
Jednak metody te mają małe znaczenie w diagnostyce klinicznej, gdyż pacjenci zgłaszają się do lekarza najczęściej w drugiej fazie choroby, wtedy, gdy wirus KZM nie jest już obecny w surowicy i w płynie mózgowo-rdzeniowym
Diagnostyka KZM
podstawą rutynowej diagnostyki KZM jest stwierdzenie za pomocą metody ELISA (enzyme-linked immunosorbent assay test) swoistych przeciwciał przeciwko wirusowi KZM
w klasie mIgM i/lub IgG, w surowicy krwi i w płynie mózgowo-rdzeniowym.
KZM dynamika przeciwciał
IgM osiągają maksymalne stężenie w surowicy i płynie mózgowo-rdzeniowym około 4..5. tygodnia choroby, a następnie zaczynają zanikać.
Jedynie w nielicznych przypadkach można je wykazać po czasie dłuższym niż 10 miesięcy od początku choroby.
IgG osiągają maksymalne stężenia około 5..6. tygodnia choroby i pozostają obecne w surowicy krwi przez około 10 lat, zapewniając w tym czasie trwałą odporność.
Profilaktyka KZM
Austria to lider wyszczepialności w zakresie kleszczowego zapalenia mózgu. Dzięki wprowadzeniu powszechnych szczepień jest to jedyny kraj w Europie, w którym notuje się stały spadek zachorowalności.
Liczba przypadków kleszczowego zapalenia mózgu od początku lat osiemdziesiątych spada tam w wyniku konsekwentnie prowadzonych szczepień. Przed wprowadzeniem masowych szczepień kleszczowe zapalenie mózgu stanowiło aż 56 proc. wszystkich wirusowych zakażeń ośrodkowego układu nerwowego w Austrii. 87 proc. mieszkańców Austrii poddało się szczepieniom, a dzięki temu liczba zachorowań zmniejszyła się ponad dziesięciokrotnie.
W Austrii odsetek zaszczepionych dzieci w wieku 1 - 12 lat sięga 80 proc.
26 proc. Niemców
17 proc. Czechów
1 proc. Polsce
Borelioza z Lyme
Borelioza z Lyme jest wielonarzadowa choroba wywołana przez krętki Borrelia burgdorferi sensu lato
(w Polsce sa to: B. burgdorferi, B. garinii, B. afzelii), przenoszone przez kleszcze Ixodes,
Poprzednia klasyfikacja przebiegu choroby na stadium wczesne (stopieo I) z erythema migrans jako głów-nym objawem, stadium drugim (stopieo II) z wczesnymi objawami z narządów po rozsianiu patogenu i stadium trzecie (stopieo III) z późnymi objawami boreliozy z Lyme, jest przestarzała ponieważ objawy kli-niczne różnych stadiów pokrywają się. Obecnie preferuje się podział na stadium wczesne równoważne stopniom I/II i stadium późne równoważne stopniowi III. Wyrażenie “przewlekła borelioza z Lyme” jest równoważna stadium III.
obraz kliniczny wiąże się
z zajęciem skóry,
stawów,
układu nerwowego
serca
Borelioza z Lyme - rozpoznanie
Podstawa rozpoznania jest stwierdzenie przynajmniej jednego z następujących objawów:
Rumień wędrujący (rumień pełzający, erythema migrans - EM)
Borrelial lymphocytoma (BL) chłoniak limfocytarny
Przewlekłe zanikowe zapalenie skóry kończyn (acrodermatitis chronica atrophicans - ACA)
Zapalenie stawów (Lyme arthritis - LA).
Zapalenia mięśnia sercowego (Lyme carditis - LC)
Neuroborelioza
Borelioza z Lyme - rumień wędrujący erythema migrans - EM)
Rozpoznanie opiera się wyłącznie na obrazie klinicznym. W postaciach typowych badania immunoserologiczne w kierunku przeciwciał anty-Borrelia burgdorferi sa zbędne.
W postaciach nietypowych potwierdzenie laboratoryjne może byc pomocne, ale dopiero po upływie co najmniej 2 tygodni od wystapienia zmiany.
EM ujawnia się w miejscu ukłucia przez kleszcza zwykle po 1-3 tygodniach (może sięgać 3 miesięcy).
Typowa zmiana początkowo ma formie plamy i szybko powiększa sie wykazujac centralne przejaśnienie. O pewnym rozpoznaniu można mówic gdy zmiana ulega powiększeniu w ciągu kilku dni i przekroczy średnice 5 cm (celowe jest zaznaczenie granic długopisem i kontrola po 1-2 dniach bez stosowania antybiotyku)..
Ujawnienie sie EM w czasie krótszym od 2 dni po ukłuciu przez kleszcza oraz średnicy mniejszej od 5 cm przemawia przeciw rozpoznaniu EM
Borelioza z Lyme - rumień wędrujący erythema migrans - EM)
EM zanika w ciągu kilku dni od rozpoczęcia prawidłowej antybiotykoterapii co jednak nie jest równoznaczne z eliminacja zakażenia.
Zmiany nieleczone mogą utrzymywać się przez kilka miesięcy, a ich samoistne ustąpienie również nie oznacza eliminacji zakażenia.
Borrelial lymphocytoma (BL)
Rozpoznanie BL wymaga wykazania obecnosci przeciwciał przeciw Borrelia burgdorferi klasy IgM lub IgG w surowicy i potwierdzenia histologicznego;
Ujawnia sie u mniej niż 1% chorych, zwykle w kilka tygodni po ukłuciu przez kleszcza, jako pojedynczy, sino-czerwony, niebolesny guzek.
Najczęstsza lokalizacja BL to małżowiny uszne, moszna i brodawki sutkowe.
Zmianie BL może towarzyszyć powiększenie okolicznych węzłów chłonnych.
Nieleczona może utrzymywać się nawet przez kilka lat, po czym ustąpić samoistnie.
Przewlekłe zanikowe zapalenie skóry kończyn (acrodermatitis chronica atrophicans - ACA)
Rozpoznanie ACA wymaga wykazania przeciwciał przeciw Borrelia burgdorferi klasy IgM lub IgG w surowicy i potwierdzenia histologicznego
Neuroborelioza
Konieczne jest potwierdzenie obecności przeciwciał klasy IgM lub IgG przeciw Borrelia burgdorferi w surowicy krwi, a w przypadku zapalenia mózgu i rdzenia kręgowego dodatkowo ich wewnątrzoponowej produkcji w celu wykluczenia biernego przenikani przeciwciał przez barierę krew-mózg.
U niektórych chorych z neuroborelioza we wczesnym stadium boreliozy z Lyme, w pierwszych tygodniach choroby nie stwierdza sie obecności przeciwciał w surowicy, wówczas badanie należy wykonać powtórnie po 2 tygodniach od ustapienia objawów choroby, a wykazana ewentualnie serokonwersja potwierdza rozpoznanie.
Płyn mózgowo-rdzeniowy (pmr) u chorych z zapaleniem opon mózgowo-rdzeniowych w przebiegu neuroboreliozy charakteryzuje sie pleocytoza limfocytowa, oraz umiarkowanym wzrostem steżenia białka i prawidłowym steżeniem glukozy.
W innych postaciach neuroboreliozy zmiany w pmr stwierdza sie rzadko.
Diagnostyka laboratoryjna
Rozpoznanie każdej postaci klinicznych boreliozy z Lyme (z wyjątkiem EM) wymaga dwuetapowego protokołu diagnostycznego:
W pierwszym etapie należy wykazać obecność swoistych przeciwciał IgM lub IgG (w
zależności od postaci klinicznej) metoda immunoenzymatyczna. ELISA
W drugim etapie u chorych z wynikami dodatnimi lub wątpliwymi należy wykonać
oznaczenia technika Western-blot
Borrelia recomblot IgM i IgG (Mikrogen Niemcy) zawierajcym rozfrakcjonowane na nitrocelulozie antygeny rekombinowane przygotowane z poszczególnych gatunków genomowych Borrelia burgdorferi.
Leczenie
w oparciu o obraz kliniczny z uwzględnieniem wyników badań dodatkowych.
Wyniki badan laboratoryjnych nie powinny zawierać żadnych sugestii terapeutycznych.
Terapia trwająca przynajmniej 21 dni opiera sie na antybiotykoterapii, która w zależności od postaci klinicznej choroby i tolerancji przez pacjenta, obejmuje przede wszystkim: doksycykline, amoksycyline, cefuroksym, ceftriakson lub cefotaksym.
Brak jest podstaw naukowych do stosowania wielomiesiecznej antybiotykoterapii lub wielokrotnego powtarzania kuracji. Badania serologiczne nie mogą być wykorzystywane do oceny skuteczności leczenia, która powinna być analizowana wyłącznie na podstawie dynamiki obrazu klinicznego.
Zmienność morfologiczna
Borrelia burgdorferi
Żywe komórki Borrelia burgdorferi charakteryzują się unikalnymi, wyróżniającymi je spośród większości bakterii, cechami.
W odpowiedzi na stres środowiskowy ruchliwe formy spiralne przeobrażają się w
(forma L, bakteria pozbawiona ściany komórkowej,
cysty ktora przybiera formę sferyczną), ukrywając materiał genetyczny w oczekiwaniu na powrót sprzyjających warunków.
Fomy blebs
Proces ten jest odwracalny, zarówno w warunkach in vitro, jak in vivo.
Z chwilą powstania cyst znikają specyficzne antygeny, które były dotychczas rozpoznawane przez układ immunologiczny, co prowadzi do zahamowania produkcji przeciwciał.
Spadek poziomu przeciwciał lub ich brak sprzyja odtworzeniu spiralnej formy krętka z cysty.
wyjaśnieniem nawracającej lub przewlekłej manifestacji narządowej jest przetrwanie w tkankach składników bakterii, które prowokują reakcje zapalne.
Borrelie mogą wytwarzać rownież formy b l e b s które zawierają głownie lipoproteiny OspA, OspB, OspD i niskocząsteczkową
Lipoproteiny te są silnymi induktorami reakcji zapalnych.
Obecność tych pęcherzyków pozakomórkowych z czynnymi biologicznie lipopeptydami w zajętych tkankach może przyczyniać się do utrzymywania się stanu zapalnego nawet wówczas, gdy nieobecne są zdolne do namnażania bakterie
Odpowiedź immunologiczna na zakażenie Borrelią
Po ukłuciu przez kleszcza bakterie Borrelia burgdorferi zajmują skórę, skąd w ciągu kilku dni potrafią się przedostać do wielu tkanek.
Ciągle brak jest jednak kompletnych i pewnych informacji wyjaśniających przebieg kolejnych faz infekcji boreliozowej, takich jak: mechanizm transportu bakterii Borrelia burgdorferi wewnątrz naczyń, rodzaj czynników umożliwiających krętkom opuszczenie systemu naczyniowego oraz szczegóły potwierdzonego już klinicznie organotropizmu.
W wyniku rozdziału elektroforetycznego lizatu całych komórek udało się zidentyfikować 30 różnych pasm białkowych, spośród których dla celów klinicznych istotne znaczenie mają głównie białka immunogenne
Niezależnie od geograficznego lub biologicznego pochodzenia borelie mają dwie główne komponenty białkowe (p41 lub flagellina) i HSP60), nazywane inaczej białkiem szoku termicznego.
Flagellina (p41), obok innych antygenów uznawanych za bardziej swoiste dla B. burgdorferi, często jest wykorzystywana w testach diagnostycznych (3).
Obecność przeciwciał skierowanych do antygenu p41 stanowi potwierdzenie odpowiedzi immunologicznej na kontakt z krętkami,
natomiast brak tych przeciwciał przemawia za zakażeniem innym niż krętkowe
Inne często stwierdzane antygeny pospolite to: p66, p68, p71, p73
Do białek specyficznych należą: OspA OspB OspC BmpA (p39), p93, p83/100, OspE (19kDa), OspF
W Europie dla człowieka chorobotwórcze są krętki:
B. burgdorferii,B. garinii,
B. afzelii
Rezerwuar:
gryzonie, zwierzyna płowa
wektor są przez kleszcze - Ixodes spp
Wyszukiwarka
Podobne podstrony:
konspekt ćw 10a, Ćwiczenia
konspekt ćw 2, Ćwiczenia
konspekt ćw 4, Ćwiczenia
konspekt ćw 5, Ćwiczenia
Konspekt ćw 9, Ćwiczenia
Konspekt ćw 1
konspekt ćw. 9, Udostępnione, Dietetyka
ćw 24 ćwiczenie$
Konspekt cwicz gimnast, Ćwiczenia gimnastyczne
konspekt ćw 10
konspekt cw 3 1 programowanie liniowe
konspekt cw 5 3 Zad 3 MRP
konspekt cw 5 2 Zad 2 MRP
konspekt cw 4 programowanie sieciowe
mikrobiologia ćw 3, Dokończenie ćwiczenia 2
Ćw nr 9, ćwiczenie 9, Paweł karaś
ćwiczenia, Praca domowa ćw 2, Chemia ćwiczenia, I rok IŚ, studia stacjonarne 2009/2010
CW NR2b, ĆWICZENIE Nr 2
Konspekt ćw I 3 Usytuowanie płodu w macicy
więcej podobnych podstron