1. Polskie normy pobierania próbek pieczywa , mięsa i przetworów mięsnych .
2. Jak z aktywnością wody wiąże się trwałością i stabilnością żywności
3. Błąd względ ny , bezwzględny oraz średnia arytmetyczna
Polskie normy pobierania próbek pieczywa , mięsa i przetworów mięsnych .
I. Pieczywo. Pobieranie próbek i kontrola jakości PN-86/ A-74104
1.1. Przedmiot normy. Przedmiotem normy jest pobieranie i przygotowanie próbek pieczywa żytniego, mieszanego, pieczywa pszennego zwykłego i wyborowego oraz półcukierniczego do badań organoleptycznych i fizykochemicznych oraz kontrola jakości.
1.2. Określenia
1.2.1. partia pieczywa — określona ilość jednego rodzaju pieczywa, o wyrównanych cechach jakościowych, o jednakowej masie, wyprodukowanego na jednej zmianie przez dany (jeden) zakład produkcyjny, przedstawiona do jednorazowego odbioru.
1.2.2. próbka pierwotna —jedna sztuka produktu pobrana jednorazowo w sposób losowy z badanej partii.
1.2.3. próbka ogólna — próbka utworzona przez połączenie wszystkich próbek pierwotnych pobranych z jednej partii.
1.2.4. próbka laboratoryjna — część próbki ogólnej przeznaczona do badań laboratoryjnych (fizykochemicznych), opakowana i przechowywana w sposób zapewniający jej niezmienność.
1.2.5. próbka do badań — próbka przygotowana z próbki laboratoryjnej, przeznaczona do badań grupy II i III.
1.2.6. liczba kwalifikująca — największa dopuszczalna liczba sztuk niedobrych w próbce, przy której należy jeszcze uznać partię za zgodną z wymaganiami.
1.2.7. liczba dyskwalifikująca — najmniejsza liczba sztuk niedobrych w próbce, przy której partię należy uznać za niezgodną z wymaganiami.
2. Postanowienia ogólne
2.1. Warunki pobierania próbek. Próbki należy pobierać w takich warunkach i w taki sposób, aby jakość i skład próbki nie uległy zmianie.
2.2. Wstępna ocena partii. Przed przystąpieniem do pobierania próbek należy ustalić przez oględziny oraz na podstawie dokumentów zgodność partii z określeniem wg 1.2.1. W przypadku stwierdzenia, że przedstawiony do odbioru produkt nie stanowi jednorodnej partii, należy przeprowadzić podział na partie odpowiadające określeniu wg 1.2.1.
2.3. Sprzęt i naczynia stosowane do pobierania i przygotowania próbek powinny być czyste, suche i wolne od obcych zapachów, wykonane z materiałów przeznaczonych do pakowania artykułów spożywczych, a ich konstrukcja powinna zapewnić możliwość szczelnego zamknięcia pobranej próbki.
2.4. Osoby pobierające i przygotowujące próbki. Próbki powinny być pobierane i przygotowane do badań przez osoby przeszkolone i upoważnione do wykonania tych czynności.
3.Kontrola jakości
3.1. Grupy badań. Badania dzieli się na trzy grupy:
grupa I — sprawdzanie masy, kształtu, barwy i pozostałych cech zewnętrznych skórki; sprawdzanie masy należy wykonać na próbce o liczności i w czasie przewidzianym w normach przedmiotowych;
grupa II — sprawdzenie grubości skórki, porowatości i elastyczności miękiszu, zapachu i smaku oraz innych cech miękiszu;
grupa III — badania fizykochemiczne.
3.2. Sposób pobierania próbek.
Próbki pieczywa należy pobierać losowo, metodą na ślepo, z różnych miejsc partii, zgodnie z PN-83/N-03010.
3.3. Liczności próbek
— dla badań grupy I — wg tabl. 1,
— dla badań grupy II i III pieczywa o masie jednostkowej do 200 g — wg tabl. 2,
— dla badań grupy II i III pieczywa o masie jednostkowej powyżej 200 g — wg tabl. 3
Tablica 1. Plany badania pieczywa (wszystkie rodzaje). Grupa badań I
|
|
Liczność |
|
Liczba kwali- |
Liczba dys- |
Liczność partii |
|
próbki |
|
fikująca |
kwalifikująca |
|
|
|
sztuk |
|
|
1 |
|
2 |
|
3 |
4 |
do 280 281- 500 501- 1200 |
|
13 20 32 |
|
1 2 3 |
2 3 4 |
1201-3200 |
50 |
|
5 |
6 |
|
3201-10000 |
80 |
|
7 |
8 |
|
Powyżej 10000 |
125 |
|
10 |
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Tablica 2. Plany badania pieczywa o masie jednostkowej do 200 g. Grupy badań II i III
Liczność partii |
Grupa badań II |
Grupa badań III |
|||
|
liczność próbki sztuk |
liczba kwalifikująca |
liczba dyskwalifikująca |
liczność próbki |
minimalna masa próbki ogólnej, g |
sztuk |
|
||||
I |
2 |
3 |
4 |
5 |
6 |
do 1200 |
5 |
0 |
1 |
4 |
300 g |
1201 - 10000 |
8 |
0 |
1 |
5 |
|
powyżej 10000 |
13 |
1 |
2 |
|
|
1) Jeżeli masa próbki ogólnej utworzonej z połączenia próbek pierwotnych w liczbie zgodnej z tabl. 2, koi. 5 jest mniejsza od 300 g. należy zwiększyć odpowiednio liczbę próbek pierwotnych. |
|||||
Tablica 3. Plany badania pieczywa o masie jednostkowej powyżej 200g.Grupy badań II i III
Liczność partii |
Grupa badań II |
Grupa badań III |
||
|
liczność próbki |
liczba kwalifikująca |
liczba dyskwalifikująca |
liczność próbki |
sztuk |
||||
1 |
2 |
3 |
4 |
5 |
do 500 powyżej 500 |
3 5 |
0 0 |
1 1 |
2 3 |
3.4. Wydzielanie próbki do badań
3.4.1. Badania grupy I przeprowadza się na wszystkich sztukach pobranych z partii do próbki o liczności zgodnej z tabl. 1, kol. 2.
3.4.2. Badania grupy II przeprowadza się na poszczególnych próbkach, uzyskanych w następujący sposób:
— z próbki, po przeprowadzeniu badań grupy I, losuje się próbkę o liczności zgodnej z tabl. 2, kol. 2, (w przypadku pieczywa o masie jednostkowej do 200 g) lub o liczności zgodnej z tabl. 3, kol. 2 (w przypadku pieczywa o masie jednostkowej powyżej 200 g),
— z każdej wylosowanej sztuki pieczywa, po przekrojeniu, wydziela się kromkę o grubości około 1,5 cm i każdą bada się oddzielnie. Sposób przeprowadzenia badań — wg PN-79/A-74108 p. 2.
3.4.3. Badania grupy III przeprowadza się na średniej próbce laboratoryjnej, przygotowanej, wg PN-79/ A-74108, p. 3.2 z próbki ogólnej o liczności zgodnej z tabl. 2, kol. 5(w przypadku pieczywa o masie jednostkowej do 200 g) lub tabl. 3, kol. 5 (w przypadku pieczywa o masie jednostkowej powyżej 200 g). Próbkę do badań grupy III losuje się z próbki po przeprowadzeniu badań grupy I.
4. Pakowanie i znakowanie próbek
4.1. Pakowanie próbek. Próbki w przypadku przesyłania poza zakład produkcyjny lub, jeśli nie przeprowadza się badań natychmiast, należy zabezpieczyć przed deformacją wysychaniem lub innymi szkodliwymi warunkami wpływającymi na zmianę jakości produktu przez zapakowanie bezpośrednio po pobraniu w papier pergaminowy, celofan, w papier woskowany, w folię polietylenową. W folie papieropodobną lub zabezpieczyć w inny sposób. Stosowane materiały opakowaniowe powinny być dopuszczone przez władze sanitarne do pakowania artykułów spożywczych.
4.2. Znakowanie. Na każdym opakowaniu z próbką należy zmieścić etykietę zawierającą co najmniej następujące dane:
— nazwę i ilość produktu,
— nazwę i adres zakładu produkcyjnego,
— datę i miejsce pobrania próbki,
— imię i nazwisko, podpis pobierającego próbkę.
5. Protokół pobrania próbek
Po zakończeniu czynności pobrania próbek i przygotowania próbki laboratoryjnej, należy sporządzić protokół pobrania próbek i przygotowania próbki laboratoryjnej. Protokół powinien zawierać następujące dane:
— rodzaj pieczywa,
— wielkość partii,
— datę wypieku i zmianę,
— miejsce, datę i godzinę pobrania,
— nazwę i adres piekarni,
— nazwę zleceniodawcy pobrania próby,
— ewentualne uwagi pobierającego próbkę,
— imię i nazwisko, znak pobierającego próbkę,
— podpisaną deklarację o następującej treści: „Próbkę................ (pełna nazwa produktu) pobrano i przygotowano zgodnie z PN-86/A-74104".
W przypadku przeprowadzenia wewnątrzzakładowej kontroli jakości pieczywa protokół pobrania próbki może być zastąpiony protokółem oceny jakości pieczywa.
6. OCENA
Partię pieczywa należy uznać za zgodną z wymaganiami , jeśli:
-w wyniku badań grupy I i II liczba sztuk niedobrych nie przekracza liczby kwalifikującej, podanej odpowiednio w tabl. 1, 2 lub 3,
- wyniki badań grupy III są zgodne z wymaganiami norm przedmiotowych w zakresie prowadzonych badań
II .Mięso i przetwory mięsne. Pobieranie i przygotowanie próbek do badań PN-ISO 3100-1:1999
1 Zakres normy
1.1 W niniejszym arkuszu normy międzynarodowej przedstawiono ogólne wskazówki oraz szczegółowe procedury pobierania próbek pierwotnych mięsa i przetworów mięsnych.
1.2 Wyróżnia się procedury pobierania próbek dotyczące następujących grup produktów:
a) partii wysyłkowych lub partii produkcyjnych mięsa lub produktów mięsnych niepakowanych lub pakowanych jako oddzielne jednostki bez względu na wielkość (na przykład kiełbasy, próżniowo pakowane mięso mielone, plasterkowane kiełbasy, puszkowane szynki pasteryzowane) lub mięsa w kawałkach o masie nie przekraczającej 2 kg;
b) tusz, części tusz lub peklowanego mięsa w kawałkach o masie przekraczającej 2 kg, (np. kawałki bekonu z kością, połówki bekonu, kawałki świeżego lub mrożonego mięsa, świeże lub mrożone mięso bez kości, połówki lub ćwiartki wołowe, połówki wieprzowe, tusze jagnięce, dziczyzna) oraz mięsa mechanicznie oddzielonego od kości lub mięsa suszonego.
1.3 Wielkość i wartość handlowa takich produktów może powodować, że konieczne jest pobieranie próbek wtórnych, stanowiących tylko część każdej próbki pierwotnej.
1.4 Niniejsze procedury pobierania próbek stosuje się generalnie dla celów handlowych. W przypadkach specjalnych, np. w przypadku oficjalnej kontroli żywności dopuszcza się zastosowanie innych procedur.
2 Norma powołana
Wymieniona niżej norma zawiera postanowienia, które - przez określone powołanie się (na daną normę) w treści niniejszej normy międzynarodowej -stają się również postanowieniami niniejszej normy. W momencie publikacji (niniejszej normy międzynarodowej), podane niżej wydanie normy było aktualne. Ponieważ jednak wszystkie normy podlegają nowelizacji, strony zawierające umowy na podstawie niniejszej normy ISO zachęca się do zbadania możliwości zastosowania najnowszego wydania wymienionej niżej normy. Rejestry aktualnych norm międzynarodowych prowadzą wszyscy członkowie ISO i IEC.
3 Definicje
W niniejszym arkuszu normy międzynarodowej ISO 3100 stosuje się definicje podane w ISO 7002.
4 Postanowienia administracyjne
4.1 Osoba pobierająca próbki
Próbki powinny być pobierane przez upoważnionego przez zainteresowane strony i odpowiednio wyszkoloną osobę pobierającą próbki. Osoba pobierająca próbki (on lub ona) powinna działać niezależnie i nie uznawać ingerencji strony trzeciej. Osoba pobierająca próbki, w czasie wykonywania swych obowiązków może być, na swoją odpowiedzialność wspomagana przez inne osoby. Osoba pobierająca próbki i osoby pomagające powinni przedsięwziąć odpowiednie środki zabezpieczające partię wysyłkową (lub partię produkcyjną i próbkę przed zanieczyszczeniem (np. przez umycie rąk przed pobieraniem próbek).
4.2 Przedstawiciele zainteresowanych stron
Przedstawiciele zainteresowanych stron powinni mieć możliwość uczestniczenia w procesie pobierania próbek.
4.3 Sprawozdanie z pobrania próbek
Do próbek laboratoryjnych należy dołączyć sprawozdanie podpisane przez osobę pobierającą próbki oraz przez przedstawicieli zainteresowanych stron, jeśli byli obecni przy pobieraniu próbek. Sprawozdanie powinno zawierać następujące informacje:
a) nazwa / nazwisko i adres osoby pobierającej próbki;
b) nazwiska i adresy przedstawicieli zainteresowanych stron;
c) miejsce, punkt, datę i godzinę pobierania próbki;
d) rodzaj i pochodzenie partii wysyłkowej lub partii produkcyjnej;
e) wielkość i liczbę jednostek stanowiących partię wysyłkową lub partię produkcyjną;
f) oznakowanie i numer partii produkcyjnej;
g) identyfikację stosowanych środków transportowych; statku, wagonów kolejowych lub ciężarówek;
h) miejsce załadunku;
i) miejsce przeznaczenia;
j) datę dostawy partii wysyłkowej lub partii produkcyjnej;
k) nazwę / nazwisko i adres sprzedającego;
l) nazwę / nazwisko i adres kupującego;
m) datę i numer listu przewozowego lub kontraktu;
n) metodę pobierania próbek;
o) liczbę próbek jednostkowych pobranych z każdej partii;
p) cechę pieczęci stosowanych na próbkach jednostkowych;
q) numery i oznakowanie partii produkcyjnych, z których pobrano próbki jednostkowe;
r) masę próbek jednostkowych;
s) miejsce, do którego próbki jednostkowe wysyłane są do badań;
Sprawozdanie powinno również zawierać informacje o warunkach pobierania próbek oraz o okolicznościach, które mogą mieć wpływ na pobieranie próbek jak np. stan opakowań, warunki otoczenia (temperatura i wilgotność powietrza), temperatura produktu i próbek jednostkowych, metody sterylizacji aparatów i pojemników na próbki oraz inne, specjalne informacje dotyczące materiału, z którego pobierane są próbki.
5 Pieczętowanie i etykietowanie
Każda próbka laboratoryjna powinna być opieczętowana i zaopatrzona w etykietę. Pieczęć powinna być umieszczona w taki sposób, aby uniemożliwić wyjęcie próbki z pojemnika lub usunięcie etykiety bez zniszczenia pieczęci.
Etykiety powinny być odpowiedniej jakości i wielkości (np. jasnej barwy, z kartonu wodoodpornegoi tłuszczoodpornego, ze wzmocnionymi dziurkami w przypadku etykiet zawieszanych). Etykieta powinna być opisana w taki sposób, aby napis nie dał się zetrzeć i powinna zawierać wszystkie informacje niezbędne do zidentyfikowania próbek pierwotnych, a w szczególności następujące:
a) charakter i pochodzenie partii wysyłkowej lub partii . produkcyjnej;
b) wielkość i liczbę jednostek stanowiących partię wysyłkową lub partię produkcyjną;
c) miejsce i datę pobrania próbek;
d) nazwę / nazwisko kupującego i sprzedającego;
e) numer i oznakowanie partii produkcyjnej, z której pobrane zostały próbki jednostkowe;
f) temperaturę powietrza w bezpośrednim otoczeniu próbek, w momencie ich pobierania.
6.Metody pobierania próbek
6.1 Wyposażenie do pobierania próbek i pojemniki na próbki jednostkowe
6.1.1 Wymagania ogólne
Materiały, z których wykonane są pojemniki, wchodzące w bezpośredni kontakt z próbkami jednostkowymi powinny być wodoszczelne i tłuszczoodporne, nierozpuszczalne i nie absorbujące.
Pojemniki powinny mieć objętość i kształt odpowiedni do rozmiaru pobieranych próbek oraz powinny być niezawodnie zamykane, w przypadku butelek, za pomocą odpowiednich korków z gumy lub plastiku lub nowych korków z korka albo zakrętek z metalu lub plastiku. Korki powinny być owinięte obojętną folią. Zakrętki powinny mieć wkładkę uszczelniającą zrobioną z obojętnego materiału.
Materiały i wyposażenie nie powinny mieć wpływu na wyniki wykonywanych badań, a w szczególności powinny spełniać wymagania wyszczególnione w punktach 6.1.2 do 6.1.4. Konieczne może być ograniczenie wpływu światła i/lub tlenu.
6.1.2 Wyposażenie do pobierania próbek i pojemniki na próbki przeznaczone do badań chemicznych :
Wyposażenie do pobierania próbek i pojemniki na próbki powinny być czyste, suche i nie powinny wpływać na skład chemiczny produktu.
6.1.3 Wyposażenie do pobierania próbek i pojemniki na próbki przeznaczone do oceny sensorycznej
Wyposażenie do pobierania próbek i pojemniki na próbki powinny\ być czyste, suche i nie powinny przekazywać produktowi żadnego zapachu ani smaku.
6.1.4 Wyposażenie do pobierania próbek i pojemniki na próbki przeznaczone do badań mikrobiologicznych i do innych celów (np. do badań biologicznych, parazytologicznych, serologicznych, histologicznych lub toksykologicznych i do badań termostatowych).
Wyposażenie do pobierania próbek i pojemniki na próbki powinny być czyste, sterylne i nie powinny wpływać na mikroflorę produktu. Sterylizacja wyposażenia do pobierania próbek i pojemników na próbki powinna być przeprowadzona jedną z następujących metod:
a) sterylizacja w nasyconej parze wodnej w temperaturze nie niższej niż 121 'C, nie krócej niż 20 min;
b) sterylizacja suchym gorącym powietrzem w temperaturze nie niższej niż 170 °C, nie krócej niż 1 h w suszarce z wymuszonym obiegiem powietrza zapewniającym, że temperatura będzie utrzymywana we wszystkich częściach suszarki;
Jeśli użycie metody a) lub b) nie będzie możliwe lub jeśli wyposażenie do pobierania próbek będzie użyte bezpośrednio po sterylizacji, można zastosować jedną z następujących metod:
c) poddanie działaniu pary wodnej o temperaturze 100 °C przez 1 h;
d) zanurzenie w 96 % (VIV) etanolu i opalenie w płomieniu;
e) opalenie płomieniem gazu (tj. propanu lub butanu) tak, aby cała powierzchnia robocza miała kontakt z płomieniem;
6.2 Liczba pobieranych próbek jednostkowych
Liczba próbek jednostkowych pobieranych w celu uzyskania próbki pierwotnej reprezentującej partię wysyłkową lub partię produkcyjną powinna być zgodna z planem pobierania próbek wyszczególnionym w kontrakcie lub innym uzgodnieniu pomiędzy zainteresowanymi stronami. Jeśli są wykonywane różne typy badań (np. chemiczne, mikrobiologiczne, fizyczne i sensoryczne) dla każdego typu badań powinny być pobrane osobne próbki jednostkowe.
6.3 Procedura pobierania próbek
6.3.1 Mięso lub przetwory mięsne niepakowane lub pakowane jako oddzielne jednostki bez względu na wielkość lub mięso w kawałkach o masie nie przekraczającej 2 kg [patrz 1.2 a)]
Jako próbki jednostkowe pobrać jednostki lub całe kawałki produktu. Liczba próbek jednostkowych pobieranych z każdej partii powinna być zgodna z planem pobierania próbek, wzmiankowanym w punkcie 6.2.
6.3.2 Tusze, części tuszy, peklowane mięso w kawałkach o masie przekraczającej 2 kg oraz mięso mechanicznie oddzielone od kości lub mięso suszone [patrz 1.2 b)]
Pobrać wymaganą liczbę pierwotnych próbek jednostkowych z każdej partii produkcyjnej zgodnie z planem pobierania próbek wzmiankowanym w 6.2 i wydzielić je w celu pobrania z nich wtórnych próbek jednostkowych do badań laboratoryjnych niszczących, (na przykład chemicznych lub mikrobiologicznych), lub w celu przeprowadzenia badań nieniszczących, (na przykład kontroli wzrokowej, oceny sensorycznej, testów mikrobiologicznych z zastosowaniem metody wymazu).
Pojedyncza próbka pobrana z tuszy lub innego dużego kawałka nie może być uznana za reprezentatywną dla całości, jak również nie jest możliwa analiza całości. Tak więc cel, dla którego pobierane są próbki pierwotne lub wtórne pociąga za sobą konieczność określenia procedury pobierania próbek.
Zazwyczaj próbki powinny być pobierane w następujący sposób:
a) próbki jednostkowe z powierzchni (np. w celu wykrywania pałeczek Salmonella lub pałeczek z grupy coli) powinny być pobierane metodą wymazu z całej powierzchni (lub z wybranych miejsc) za pomocą dużego wilgotnego tamponu lub (przy oznaczaniu liczby drobnoustrojów) przez pobieranie wycinków z powierzchni ograniczonej szablonem, a w przypadku mięsa mrożonego przez zeskrobywanie tych powierzchni;
b) wtórne próbki jednostkowe o masie od 500 g do 1 kg do badań chemicznych lub mikrobiologicznych wykonywanych w laboratorium powinny być pobierane, w miarę możliwości, w miejscach istniejących cięć powierzchni, w taki sposób, aby powstałe uszkodzenia były możliwie jak najmniejsze;
c) próbki jednostkowe pochodzące z warstw głębokich mięśni przeznaczone do badań mikrobiologicznych (na przykład dla zbadania powodów gnicia głębokiego przy kości) powinny być pobrane z zaatakowanych części tuszy za pomocą przyrządu do wycinania mięśni wykonanego ze stali nierdzewnej lub w przypadku mięsa mrożonego, za pomocą świdra;
d) próbki jednostkowe tłuszczu (np. do oznaczania związków rozpuszczalnych w tłuszczach, takich jak pestycydy), jeśli to możliwe, powinny być pobrane z tłuszczu okołonerkowego;
e) próbki jednostkowe wycieku np. z próżniowo pakowanego, chłodzonego mięsa, powinny być pobrane aseptycznie, przez folię lub po otwarciu opakowania, z użyciem sterylnej igły i/lub kolby lub butelki. Jeśli mięso wraca do partii produkcyjnej, powinno to nastąpić po powtórnym zapakowaniu próżniowym.
6.3.3 Temperatura
Tam, gdzie to jest możliwe, należy rejestrować temperaturę każdej partii produkcyjnej, z której pobierane są próbki.
6.4 Pakowanie próbek jednostkowych
6.4.1 Mięso lub przetwory mięsne niepakowane lub pakowane jako oddzielne jednostki bez względu na wielkość lub mięso w kawałkach o masie nie przekraczającej 2 kg
[patrz 1.2 a)]
W przypadku, gdy produkty są pakowane w opakowanie ściśle przylegające to wówczas nie wymaga się innego opakowania próbek jednostkowych. Jeśli nie są tak opakowane, należy każdą próbkę jednostkową zapakować w odpowiedni pojemnik na próbki, który następnie należy zamknąć, zapieczętować i zaopatrzyć w etykietę (patrz rozdział 5 i podrozdział 6.1)
6.4.2 Tusze, części tuszy, peklowane mięsow kawałkach o masie przekraczającej 2 kg oraz mięso mechanicznie oddzielone od kości lub mięso suszone [patrz 1.2 b)j
Zapakować każdą próbkę jednostkową w plastikowy worek z odpowiedniego materiału , zamknąć, zapieczętować i zaopatrzyć w etykietę (patrz rozdział 5 i podrozdział 6.1)
Tampony z wymazów do badań mikrobiologicznych umieścić w sterylnych pojemnikach, a próbki wycieków w sterylnych kolbach lub butelkach.
UWAGA 1 Jeśli możliwe jest zapakowanie różnych próbek jednostkowych razem do jednego lub kilku pojemników, wtedy nie jest wymagane etykietowanie i pieczętowanie każdej próbki jednostkowej, jeśli etykiety i pieczęcie są umieszczone na tych pojemnikach zgodnie z rozdziałem 5 i podrozdziałem 6.1
6.5 Transport i przechowywanie próbek jednostkowych
Pobrane próbki jednostkowe powinny być przesłane do laboratorium tak szybko, jak to jest możliwe. W tym czasie próbki powinny być trzymane w takiej temperaturze, jaka jest wymagana do przechowywania określonego produktu. W przypadku produktów wymagających chłodzenia transportować próbki jednostkowe następująco:
a) w temperaturze od 0 "C do 2 °C, jeśli będą badane w ciągu 24 h od ich pobrania, lub
b) zamrożone w temperaturze nie wyższej niż -24 °C, w innych przypadkach; jednakże próbek przeznaczonych do badań fizycznych lub sensorycznych generalnie nie należy mrozić.
Podczas transportu zabezpieczyć próbki jednostkowe przed bezpośrednim działaniem słońca. Próbki jednostkowe powinny być dostarczone do laboratorium w stanie nieuszkodzonym, z nienaruszonymi pieczęciami.
II . Jak z aktywnością wody wiąże się trwałością i stabilnością żywności
1.Pojęcie aktywności wody
Zależność między zawartością wody a trwałością żywności jest oczywista. Jej zawartość decyduje o możliwości rozwoju niebezpiecznej dla człowieka mikroflory. Jednakże produkty żywnościowe o takiej samej zawartości wody znacznie się różnią podatnością na psucie. Już pół wieku temu zaobserwowano, że większość parametrów decydujących o jakości i trwałości żywności nie jest powiązanych z całkowitą zawartością wody, ale jej aktywnością.
Woda zawarta w materiale biologicznym jest roztworem wielu związków chemicznych. Prężność pary roztworów jest mniejsza niż prężność pary czystego rozpuszczalnika. Stopień zmniejszenia prężności pary wyraża prawo Raoulta :
P/Po = n2 / nt + n2 = aw
gdzie: p i p0 to odpowiednio prężności par roztworu i czystego rozpuszczalnika w danej temperaturze, nt i n2 - stężenia molowe substancji rozpuszczonej i rozpuszczalnika, aw - aktywność wody.
Aktywność wody może przyjmować wartości od 1 dla czystej wody do ok. 0 dla układów o niewielkiej zawartości wody.
Wilgotność względna powietrza jest definiowana podobnie, ale zazwyczaj jest wyrażana w procentach. Aktywność wody jest miarą zawartości wody wolnej w danym materiale, umożliwia więc określenie intensywności, z jaką woda asocjuje z różnymi niewodnymi składnikami. Woda związana jest mniej dostępna. Przebieg wielu ważnych reakcji chemicznych i biochemicznych, a także możliwość rozwoju drobnoustrojów dużo lepiej można przewidzieć korzystając z aktywności wody niż jej całkowitej zawartości. Dlatego ten parametr zyskał znaczenie jako wskaźnik stabilności i bezpieczeństwa mikrobiologicznego żywności.
Również od dawna wiadomo, że normalne funkcjonowanie biologiczne nawet organizmów jednokomórkowych zależy w decydującym stopniu od aktywności wody. Znane są przykłady prostych organizmów zdolnych do przeciwdziałania nagłym wstrząsom osmotycznym, tzn. zdolnym do zmiany aktywności wody w ich cytozolu przez syntezę cząsteczek znanych ze swych szczególnych właściwości hydratacyjnych.
Zaostrzenie rygorów dotyczących jakości żywności, obejmujących regulacje prawne, wymagania konsumentów, kontrole procesów produkcyjnych gwarantującą wytwarzanie zdrowej i bezpiecznej żywności sprawiło, że aktywność wody zyskała znaczenie jako krytyczny parametr kontroli jakości. Poprzednio pomiar aw miał zasięg ograniczony. Był stosowany przy wprowadzaniu nowych produktów lub w badaniach naukowych. Nowe przyrządy pomiarowe umożliwiły jego zastosowanie w bieżącej kontroli produkcji i jakości, testowaniu opakowań, kontroli mikrobiologicznej i właściwych warunków transportu.
Aktywność wody lub inaczej względną prężność pary oznacza się przez umieszczenie małej próbki substancji badanej w zamkniętej komorze na czas wystarczający do osiągnięcia równowagi, a następnie mierzy się ciśnienie lub wilgotność względną w komorze. W handlu są dostępne nowoczesne przyrządy pomiarowe zbudowane na bazie mikroprocesorów przystosowane do szybkich, dokładnych i wielokrotnych pomiarów aw [6].
2. Aktywność wody a trwałość żywności
Aktywność wody ma wpływ na wiele czynników decydujących o trwałości żywności .
Bezpośredni związek z aktywnością wody ma rozwój mikroflory. Drobnoustroje nie mogą się rozmnażać, gdy aw < 0,6. Poszczególne grupy drobnoustrojów rozwijają się w różnych zakresach aktywności wody, ale większość z nich wymaga aw > 0,8. Wyjątkiem są drożdże osmofilne i niektóre pleśnie, które mogą rozmnażać się przy aw = 0,6-0,65.
Zawartość wody ma wpływ na konformację białek enzymatycznych, które decydują o aktywności i zdolności katalitycznej enzymów. Brak fazy wodnej uniemożliwia transport substratów i produktów reakcji. Większość reakcji enzymatycznych rozpoczyna się wraz z pojawieniem się wody luźniej związanej, to jest powyżej aktywności odpowiadającej warstwie monomolekularnej. Gdy aw < 0,3, szybkość reakcji hydrolizy enzymatycznej staje się nieistotna. Działanie innych grup enzymów, takich jak amylazy, fenolooksydazy, peroksydazy, jest hamowane, gdy aw < 0,8.
Niektóre reakcje nieenzymatyczne zachodzą z maksymalną szybkością przy średnich wartościach aktywności wody. Powodem spadku szybkości reakcji przy większych wartościach aw może być efekt rozcieńczenia lub hamowanie przez produkt, gdy woda jest jednym z produktów reakcji. Taki przebieg ma reakcja Maillarda, prowadząca m.in. do utraty lizyny i odpowiedzialna za brązowienie oraz degradację witaminy![]()
.
Duży wpływ na trwałość i jakość żywności mają reakcje utleniania. Woda może sprzyjać procesom utleniania przez zwiększenie ruchliwości i rozpuszczalności jonów metali uczestniczących w tych reakcjach, jak też przez pęcznienie białek, które ułatwiają działanie rodników powstających w procesach utleniania lipidów. Przy zawartości wody związanej w warstwie monomolekularnej szybkości reakcji utleniania zachodzących zarówno w fazie wodnej, jak i w fazie lipidowej są bardzo małe.
Przeciwutleniające działanie wody może być spowodowane m.in.: utrudnieniem dyfuzji tlenu do miejsc reakcji, zmniejszeniem stężenia jonów metali, wiązaniem produktów pośrednich autooksydacji lipidów, przyspieszeniem tych reakcji, których produkty mają właściwości przeciwutleniające.
Przemiany fizyczne związane z aktywnością wody i mające wpływ na jakość i trwałość produktów żywnościowych to krystalizacja lub rozpuszczanie niektórych składników żywności. Krystalizacji ulegają przede wszystkim sacharydy, występujące zazwyczaj w żywności w postaci amorficznej. Krystalizacja zachodzi najczęściej przy aw = 0,3-0,5. Sacharydy w postaci amorficznej, ze względu na bardziej rozwiniętą powierzchnię, wiążą znacznie więcej wody niż w postaci krystalicznej. Woda uwalniana w procesie krystalizacji powoduje jakościowe zmiany produktu, polegające na utracie kruchości wyrobów piekarniczych, zbrylaniu produktów suszonych oraz przyspieszaniu reakcji chemicznych. Następstwem sorpcji wilgoci przez substancje krystaliczne (sacharoza, glukoza, sól kuchenna, kwas cytrynowy), zachodzącej przy aw = 0,6-0,7, jest ich częściowe rozpuszczanie powodujące zlepianie kryształów i zbrylanie.
Zakres zmian fizycznych, biochemicznych, chemicznych i mikrobiologicznych zachodzących w czasie przechowywania żywności w znacznym stopniu można ograniczyć przez zmniejszenie zawartości wody lub przeprowadzenie wody wolnej w wodę związaną, niedostępną dla wymienionych przemian pogarszających jakość żywności.
Najczęściej stosowanymi metodami są: suszenie, wędzenie, zamrażanie i dodawanie substancji zmniejszających aw (metody osmoaktywne) [2, 3, 8].
Suszenie jest najstarszym sposobem utrwalania żywności. Znane jest od zarania historii ludzkości. Przez suszenie można zmniejszyć zawartość wody do poziomu 3-10%, co odpowiada aw = 0,25-0,4. Taki poziom odwodnienia uniemożliwia rozwój mikroflory i hamuje większość przemian powodujących psucie. Pełne zabezpieczenie trwałości suszonych produktów żywnościowych w czasie ich przechowywania uzyskuje się przez dobór właściwego opakowania i warunki składowania zabezpieczające przed ponownym wchłanianiem wilgoci.
Wędzenie i solenie ma podobny skutek. Nasycony roztwór soli kuchennej ma aw ok. 0,75. Dodanie odpowiedniej ilości soli zabezpiecza żywność przed zepsuciem.
Zamrożenie unieczynnia wodę dzięki przeprowadzeniu jej w lód. Wymrożeniu ulega woda wolna i częściowo woda słabo związana. Aktywność wody w produkcie zamrożonym zależy od rodzaju produktu i od temperatury końcowej. Niezależnie od składu produktu mrożonego (roztwór wodny, zawiesina komórek czy tkanka), woda w nim zawarta zostaje przekształcona w lód o wysokim stopniu czystości. Składniki niewodne ulegają więc zagęszczeniu w malej ilości nie zamrożonej wody, a stopień zagęszczenia zależy od temperatury końcowej. Z powodu zagęszczenia wiele właściwości, takich jak pH, stopień dysocjacji, silą jonowa, lepkość, temperatura zamarzania, napięcie powierzchniowe i międzyfazowe, potencjał oksydoredukcyjny, lokalizacja makrocząsteczek i struktur nadcząsteczkowych, a wreszcie struktura wody niewymrożonej i jej oddziaływania ze składnikami niewodnymi, ulegają drastycznym zmianom. Konsekwencją zamrażania są dwa przeciwstawne efekty: z jednej strony obniżenie temperatury (oprócz zmiany aktywności wody, zmniejsza szybkość reakcji), a z drugiej zatężenie, które może być przyczyną wzrostu ich szybkości W żywności mrożonej zachodzi więc wiele reakcji enzymatycznych, jak i nieenzymatycznych zmieniających jej jakość. Przykładami reakcji nieenzymatycznych są: hydroliza kwaśna sacharozy, utlenienie kwasu askorbinowego, tokoferolu, witaminy i prowitaminy A, tłuszczów, mioglobiny, zmniejszenie rozpuszczalności białek. Do najczęściej występujących reakcji enzymatycznych należą: przekształcenie glikogenu w kwas mlekowy, rozkład fosforanów wysokoenergetycznych, hydroliza fosfolipidów, rozkład nadtlenków, utlenianie kwasu askorbinowego. Intensywność tych procesów jest największa w temperaturze niewiele niższej od temperatury zamarzania. Dla reakcji enzymatycznych jest to temperatura od -2 do -8°C [5].
W metodach osmoaktywnych utrwalania żywności, obniżenie aw polega na częściowym odwodnieniu lub dodawaniu substancji mających zdolność trwałego wiązania wody. W pierwszym przypadku mamy do czynienia z zagęszczaniem. Metoda ta znalazła zastosowanie do zagęszczania mleka, soków, zup i powoduje zmniejszenie aw do wartości 0,85-0,9, co nie zabezpiecza w pełni trwałości żywności. Stosuje się dodatkowo obróbkę cieplną. Inną metodą jest połączenie zagęszczania z dodawaniem substancji wiążących wodę. W zależności od rodzaju produktu stosuje się sacharydy, NaCl, białko mleka lub soi, glicerol, sorbitol, glikol propylenowy. Zastosowanie kilku różnych substancji jednocześnie powoduje wiązanie wody niezależnie przez każdą z nich. Zmniejszenie aw w mieszaninie wieloskładnikowej można obliczyć wg równania Rossa [11]
![]()
gdzie ![]()
jest aktywnością wody w danym układzie , ![]()
to aktywność wody związanej z każdym ze składników układu .
Metodą osmoaktywną zazwyczaj otrzymuje się żywność o średniej zawartości wilgoci IMF. Asortyment tej żywności, o zmodyfikowanej wartości energetycznej i odżywczej oraz specyficznych cechach sensorycznych jest coraz większy. Wszystkie wymienione metody mają na celu skuteczną ochronę żywności przed rozwojem niebezpiecznych dla człowieka drobnoustrojów i procesami pogarszającymi jej jakość. Trzeba jednak pamiętać, że usunięcie wody przez odwodnienie lub krystalizację poważnie zmienia natywne właściwości każdego materiału biologicznego. Powtórne nawodnienie lub rozmrożenie nie przywraca w pełni stanu wyjściowego.
Aktywność wody nie jest wskaźnikiem doskonałym. W przewidywaniach trwałości żywności należy brać pod uwagę także i inne czynniki, takie jak ruchliwość wody i reagentów, strukturę związków wiążących wodę, pH, stężenie tlenu. Trwałość żywności suszonej może wynikać nie tylko z małej aw ale także unieruchomienia zawartych w niej składników i przez to ich niedostępności jako reagentów reakcji lub jako pożywienia dla drobnoustrojów. Rozwój drobnoustrojów zależy nie tylko od aw, ale także od rodzaju substancji dodanej w celu związania wody. Niektóre substancje dodawane w tym celu powodują zmianę właściwości fizykochemicznych produktu, np. zmiękczanie lub ochronę przed zamrożeniem. Próby wyjaśnienia tych efektów wykorzystujące aw nie były uwieńczone powodzeniem i wprowadziły zamieszanie w poglądach na rolę wody w funkcjonalnych właściwościach żywności. Pomiary właściwości wody związanej metodami I7O NMR i relaksacji dielektrycznej wykazały ogromne różnice w jej ruchliwości w zależności od rodzaju substancji wiążącej. Cząsteczki wody związanej z monosacharydami są ok. 10-krotnie mniej ruchliwe niż w czystej wodzie, ale znacznie bardziej ruchliwe niż te, które są związane z polimerami sacharydów. W przypadku monosacharydów ma znaczenie nie tylko liczba grup OH zdolnych do tworzenia wiązań wodorowych, ale także ich położenie i konfiguracja. Uzyskane wyniki sugerują, że o dostępności wody decyduje nie tylko względna prężność pary (aw), ale także jej ruchliwość translacyjna i rotacyjna oraz różnice w energii wiązania cząsteczek wody z substancjami o różnej strukturze i właściwościach [2].
3. Aktywność wody i izotermy sorpcji
Nie ma prostej zależności między zawartością wody w danym produkcie żywnościowym a jej aktywnością (tab. 1) [14].
Tabela 1. Zawartość wody i jej aktywność aw w wybranych produktach żywnościowych
Produkt |
Zawartość wody % |
aw |
Produkt |
Zawartość wody % |
aw |
Owoce |
90 |
0,97 |
Chleb |
35-40 |
0,69 |
Warzywa |
90 |
0,97 |
Dżem |
30-35 |
0,82-0,94 |
Soki |
90 |
0,97 |
Miód |
10-20 |
0,75 |
Jaja |
70-80 |
0,97 |
Cukier |
< 10 |
0,10 |
Mięso |
60-70 |
0,97 |
Płatki zbożowe |
< 10 |
0,10 |
Sery |
34-40 |
0,96 |
Owoce suszone |
20-25 |
0,72-0,80 |
Przedstawiona graficznie zależność między wilgotnością materiału (wyrażoną jako masa wody na jednostkę suchej masy substancji) i aw w danej temperaturze nosi nazwę izotermy sorpcji. Jej przebieg zależy od składu chemicznego, ale dla większości produktów żywnościowych charakterystyczne są izotermy o kształcie sigmoidalnym.
Izotermy sorpcji w różnych temperaturach można obliczyć, stosując równanie Clausiusa-Clapeyrona
d(lnaw)/d(l/T)=ΔH/R
gdzie: aw - aktywność wody, T— temperatura, ΔH - ciepło sorpcji i R — stała gazowa.
Izotermy można skonstruować, wykorzystując proces dehydratacji (desorpcja) lub powtórnej hydratacji (resorpcja) produktu uprzednio wysuszonego. Izoterma desorpcji ma inny przebieg niż izoterma adsorpcji. Zazwyczaj dla danej wartości aw zawartość wody w żywności jest większa podczas desorpcji niż resorpcji. Izotermy sorpcji większości produktów żywnościowych charakteryzują się występowaniem pętli histerezy (rys. 1).
Rys.1 Histereza izoterm sorpcji wody
Wielkość histerezy, kształt krzywej, punkty początkowy i końcowy pętli mogą się znacznie różnić w zależności od rodzaju żywności, temperatury, szybkości i stopnia odwodnienia. Przyczynami histerezy są nieodwracalne zmiany strukturalne produktu, jako następstwo zmian konformacyjnych makrocząstek, zmiany postaci krystalicznej lub rozpuszczenie niektórych składników, np. sacharydów.
Kształt izotermy sorpcji odzwierciedla mechanizm wiązania i właściwości wody w danym materiale. Pomocą w zrozumieniu znaczenia i użyteczności izotermy jest jej podział na trzy strefy [5]. Właściwości wody w każdej z nich są inne.
Strefa I, aw < 0,25, odpowiada adsorpcji monomolekularnej i obejmuje wodę najsilniej związaną, która zachowuje się jak część substancji stałej. Według zaproponowanego poprzednio podziału obejmuje wodę strukturalną i wodę związaną w postaci monowarstwy. W materiale o dużej wilgotności ta woda stanowi małą frakcję wody całkowitej. Charakteryzuje się ona małą ruchliwością, nie zamarza w temp. -40°C, nie jest dostępna
jako rozpuszczalnik, nie ma właściwości zmiękczających. Entalpia odparowania tej frakcji jest znacznie większa niż wody czystej. Adsorpcja mono-molekularna nia oznacza, że cała powierzchnia suchego materiału jest pokryta powłoką jednowarstwowo upakowanych cząsteczek H2O. Należy ją rozpatrywać jako przybliżoną liczbę cząsteczek wody potrzebnych do utworzenia monomolekularnej powłoki wokół dostępnych grup polarnych materiału suchego, przez oddziaływanie typu woda-jon i woda-dipol.
Strefa II, aw = 0,25-0,7, odpowiada adsorpcji wielowarstwowej. Dodane cząsteczki wody wypełniają wolne miejsca pierwszej warstwy i tworzą kilka następnych warstw wokół grup hydrofilowych wykorzystując wiązania wodorowe woda-substancja i woda-woda. Entalpia odparowania tej frakcji jest nieco większa niż czystej wody. Większość tej wody nie zamarza w temp. -40°C, gdy aw zbliża się do wartości 0,7, następuje pęcznienie i zmiękczanie substancji oraz rozpuszczanie niektórych składników. Przez zwiększenie mobilności reagentów, woda związana wielowarstwowo umożliwia przyspieszenie większości reakcji wpływających na jakość i trwałość żywności.
Strefa III, aw > 0,7, zawiera wodę najsłabiej związaną, o wartościach, takich jak w rozcieńczonych roztworach soli. Entalpia odparowania jest prawie taka sama jak wody czystej. Ta frakcja wody podlega zamarzaniu, jest dostępna jako rozpuszczalnik, umożliwia przemiany chemiczne i biochemiczne oraz rozwój drobnoustrojów. Może występować jako woda uwięziona (kondensacja kapilarna) lub wolna. W żywności o dużej wilgotności woda strefy I i II stanowi ok. 5%, a woda strefy III - 95% całkowitej ilości wody. Granice stref nie są ściśle ustalone i z wyjątkiem cząsteczek wody strukturalnej wszystkie inne podlegają wymianie.
4. Zastosowanie izoterm sorpcji w technologii żywności
Analiza izoterm sorpcji ma zastosowanie praktyczne. Znajomość krytycznej wilgotności ma istotne znaczenie w przetwórstwie, przechowywaniu i transporcie żywności. Zawartość wody odpowiadająca pojemności warstwy monomolekularnej jest minimalną i zarazem optymalną wilgotnością ze względu na trwałość produktu. Nadmiar wody w stosunku do warstwy mono-molekularnej prowadzi do osiągnięcia wilgotności krytycznej, której przekroczenie wywołuje różne niepożądane zmiany w produkcie obniżające jego jakość oraz umożliwia rozwój drobnoustrojów.
Izotermy sorpcji umożliwiają dobranie odpowiednich parametrów do procesów zagęszczania i suszenia oraz określenie końcowych punktów tych procesów odpowiadających pożądanej aktywności wody w gotowych produktach.
Znajomość izoterm sorpcji jest niezbędna dla ustalenia optymalnych warunków przechowywania żywności suszonej oraz doboru odpowiednich opakowań.
Izotermy sorpcji są wykorzystywane przy mieszaniu suchych produktów żywnościowych o różnej higroskopijności (koncentratów, ciast, odżywek, napojów). W hermetycznie zamkniętej mieszaninie wieloskładnikowej ustala się równowaga aktywności wody przez dyfuzję pary wodnej z materiału o większej aw do materiału o mniejszej aw . Zwiększenie zawartości wody w składnikach o mniejszej aktywności odzwierciedla izoterma adsorpcji, a zmniejszenie wilgotności - izoterma desorpcji.
III. Błąd względny , bezwzględny oraz średnia arytmetyczna
W procesie oznaczeń analitycznych z reguły pomiary powtarzamy wielokrotnie, wychodząc słusznie z założenia, że ,, jeden wynik to żaden wynik Zatem seria powtarzanych pomiarów daje wartość pojedynczych wyników x2…….xn. Z tych pojedynczych pomiarów można obliczyć średnią arytmetyczną :
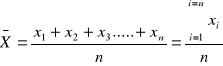
Błąd bezwzględny (absolutny), Eabs, określamy jako różnicę między zmierzoną wartością x a wartością rzeczywistą , μ tj.
Eabs= x -μ
Błąd bezwzględny może mieć znak dodatni gdy ,x>μ, lub ujemny, gdy x < μ. Często błąd bezwzględny wyrażamy nie zwracając uwagi na znak, czyli
Eabs=[ x -μ]
W przypadku gdy posługujemy się wartością średnią ![]()
, błąd bezwzględny wyrażamy w postaci:
![]()
Błąd względny (relatywny) opisujemy równaniem:
![]()
i często w praktyce analitycznej wyrażamy w procentach:
![]()
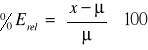
Zad . Oblicz średnią arytmetyczną , błąd względny i bezwzględny dla :
9;11;13;10;15;16;14,5;12;12,2;13,3 gdzie μ= 13
![]()
![]()
![]()
![]()
Praca pochodzi z serwisu www.e-sciagi.pl <<<>>> Zacznij zarabiać http://partner.e-sciagi.pl
Wyszukiwarka
Podobne podstrony:
ibp Pieczywo cukiernicze
Analiza sitowa próbki
Ustawa o wspieraniu rodziny i systemie pieczy zastepczej
Wpływ wartości wypiekowej mąki piekarskiej na właściwości pieczywa 16
4 Co to są linie poślizgu widoczne na powierzchni próbki ze stali GX120Mn13
Materialoznawstwo i Techniki Wy Probki id 284448
Przepisy na pasty do pieczywa, Przepisy kulinarne
Charakterystyka towaroznawcza pieczywa z uwzględnieniem podstawowego składu, Nauka, Piekarnictwo
Próbki polimerów, studia, biomateriały w środowisku aktywnym
pieczywo slodkie
1 bez pieczy, studia
spr woda3 próbki, technologia wody i sciekow Jachimko
Krajalnica pieczywa, Instrukcje-Bezpiecznej Pracy
Zawijane pieczywo lavash
Lekki fotel,poj na pieczywo
Obrobka probki 100 elementowejP
teoria opis próbki
więcej podobnych podstron