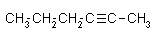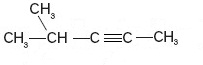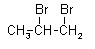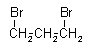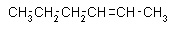Izomeria w związkach organicznych
Chemia organiczna to chemia związków atomów węgla i wodoru. Węgiel to szósty pierwiastek układu okresowego. Położony jest w grupie 14., drugim okresie, a na swojej elektronowej powłoce walencyjnej 4 elektrony. Wiązania występujące w związkach organicznych w większości to wiązania kowalencyjne oraz mogą łączyć się ze sobą tworząc dowolnej długości, proste bądź rozgałęzione łańcuchy. W wyniku połączenia kilku, kilkunastu lub większej liczby atomów węgla mogą też powstawać pierścienie, które są podstawowym elementem budowy związków pierścieniowych, nazywanych inaczej związkami cyklicznymi.
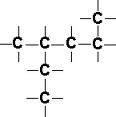
Łańcuch prosty
b)
Łańcuch rozgałęziony
c)
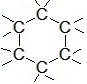
Pierścień
Atomy węgla w cząsteczkach są wyłącznie IV wartościowe, czyli łączą się z innymi pierwiastkami za pomocą czterech wiązań, które mogą być pojedyncze (atom węgla zawierający wyłącznie takie wiązania połączony jest z czterema innymi atomami), podwójne oraz potrójne (atom węgla połączony jest z odpowiednio mniejszą liczbą innych atomów). Związki, w których występuje wiązanie pojedyncze nazywamy nasyconymi, a takie, w których występują wiązania wielokrotne - nienasyconymi.
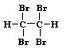
a)
Związek nasycony - alkan.
1,1,2,2-tetrabromoetan
b)
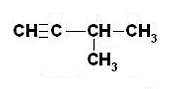
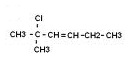
Związek nienasycony - alken.
2-chloro-2-metylopent-3-en.
c)
Związek nienasycony - alkin.
3-metylobut-1-yn.
Wyżej wymienione właściwości węgla sprawiają, że dzięki niemu związki w chemii organicznej są tak różnorodne. Inną przyczyną tego zjawiska jest tzw. izomeria (izos- równy, meros- część). Jest to występowanie związków chemicznych różniących się budową cząsteczki oraz właściwościami chemicznymi i fizycznymi. Poszczególne związki w izomerii nazywane są izomerami. Jako ciekawostkę mogę dodać, że znanych jest 5 związków o wzorze sumarycznym C6H14, 18 o wzorze C8H18 i aż 75 o wzorze C10H22 . Z tego wynika, że wraz ze wzrostem atomów w cząsteczce liczba izomerów wzrasta.
Izomeria dzieli się na dwa główne rodzaje: izomerię konstytucyjną (strukturalną) oraz izomerię przestrzenną (stereoizomerię). W izomerii konstytucyjnej izomery różnią się kolejnością i sposobem powiązywania atomów w cząsteczce, a w izomerii przestrzennej izomery różnią się rozmieszczeniem atomów w przestrzeni przy tej samej kolejności powiązania atomów.
Poniżej zaprezentuję jakie rodzaje izomerii zaliczamy do izomerii strukturalnej a jakie do stereoizomerii.
Izomeria konstytucyjna
Szkieletowa
Podstawienia (położenia)
Położenia podstawnika
Położenia wiązania wielokrotnego
Funkcyjna (metameria)
Tautomeria
Izomeria przestrzenna
Konformacyjna
Geometryczna
Optyczna
Enancjomery
Diastereoizomery
Poniższy schemat obrazuje podział izomerii.
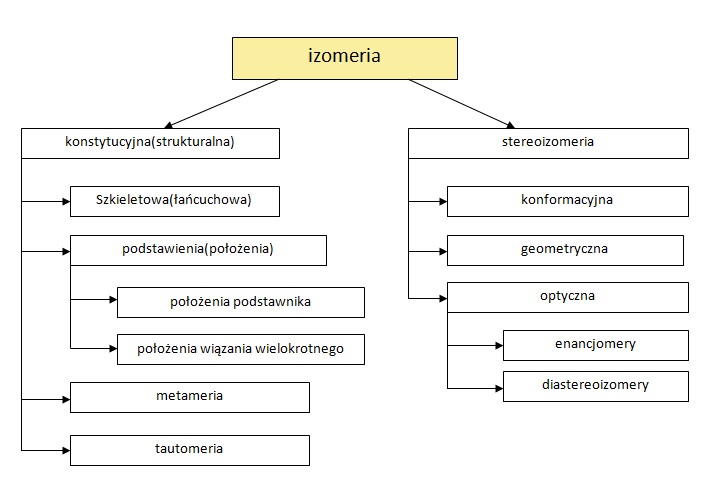
Teraz omówię wszystkie wyżej wymienione rodzaje izomerii wraz z podaniem przykładów. Omówienie będzie zgodne z kolejnością, którą przedstawia powyższy schemat.
Izomeria szkieletowa (łańcuchowa)
W izomerii łańcuchowej izomery różnią się kształtem szkieletu węglowego (układu atomów wraz z łączącymi je wiązaniami). Łańcuch może być prosty lub rozgałęziony.
Łańcuch prosty.
heks-2-yn
Łańcuch rozgałęziony.
4-metylopent-2-yn.
Podane związki należą do grupy węglowodorów zwanej alkinami, gdyż pomiędzy 2 a 3 węglem występuje wiązanie potrójne. Przedstawiony został ten sam związek o wzorze sumarycznym C6H10. Jedna grupa zmieniła swoje miejsce jednocześnie przyłączając jeden wodór od grupy CH2, do której się przyłączyła.
Izomerię podstawienia (położenia) można podzielić na dwa rodzaje.
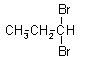
Pierwszy z nich to izomeria zmiany położenia podstawnika. Związana jest ona ze zmianą położenia podstawnika w cząsteczce.
1,1-dibromopropan
1,2-dibromopropan
1,3-dibromopropan
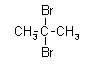
2,2-dibromopropan
Podany związek należy do grupy węglowodorów zwanej alkanami. Pomiędzy wszystkimi węglami w związku występuje wiązanie pojedyncze. Wszystkie podpunkty (a-d) przedstawiają ten sam związek C3H6Br2. Każdy przedstawiony wzór jest poprawny, gdyż ten związek można zinterpretować na 4 przedstawione powyżej sposoby. Swoje położenie zmieniały jedynie atomy bromu, które podczas reakcji substytucji, zachodzącej pod wpływem światła, zostały podstawione w miejsce atomów wodoru.
Drugi rodzaj stanowi izomeria zmiany położenia wiązania. Występuje ona w związkach nienasyconych. Dotyczy ona różnego położenia wiązań podwójnych lub potrójnych w cząsteczce.
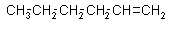
Heks-1-en
Heks-2-en
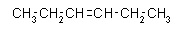
Heks-3-en
Podany związek należy do grupy węglowodorów zwanych alkenami, gdyż pomiędzy atomami węgla występuje wiązanie podwójne. Są to związki nienasycone. Wzór tego związku to C6H12. Jeżeli zmienione zostaje położenie wiązania przed końcówką -en należy dodać numer atomu węgla, przy którym występuje wiązanie podwójne. Ta sama zasada dotyczy alkinów.
Metameria
Nazywana jest także izomerią funkcyjną. Jest to rodzaj izomerii, w której związki mają taką samą liczbę tych samych atomów, ale różnią się grupami funkcyjnymi jakie posiadają lub położeniem wiązania wielokrotnego.
I. Różne grupy funkcyjne
CH3COOH
Kwas octowy
HCOOCH3
Mrówczan metylu
CH3CH2CHO
Aldehyd propionowy
d) CH3COCH3
Aceton
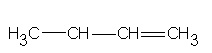
II.Zmiana położenia wiązania wielokrotnego
But-1-en
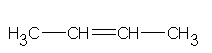
b)
but-2-en
W punkcie pierwszym związki a) i b) oraz c) i d) mają taką samą liczbę takich samych atomów, ale mają inne grupy funkcyjne, co sprawia, że są one dwoma różnymi związkami. Podpunkty a) i b) to związki o wzorze C2H5O2, natomiast c) i d) - C2H6O. W punkcie drugim zostało zmienione miejsce położenia wiązania podwójnego. Ten typ izomerii możemy zaliczyć również do izomerii szkieletowej.
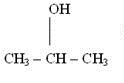
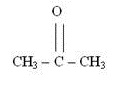
Tautomeria
W tego rodzaju izomerii podobnie jak w izomerii funkcyjnej liczba atomów jest taka sama i są one takie same, jednakże są one inaczej ze sobą połączone.
Propan-2-ol
Propanon
Związki te podobnie jak w metamerii mają taką samą liczbę takich samych atomów, jednakże różnią się ich połączeniem. W podpunkcie a) pomiędzy grupą OH występuje wiązanie pojedyncze, natomiast w b) do atomu węgla bezpośrednio przyłączony jest tlen, a wiązanie jest podwójne.
Izomeria konformacyjna
W tym rodzaju izomerii związki posiadają identyczne wzory strukturalne oraz takie samo połączenie atomów, ale występuje różne rozmieszczenie w przestrzeni. Następuje rotacja dookoła wiązania C-C.
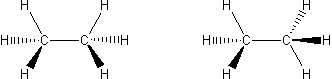
Wzory stereostrukturalne etanu
Rysunki przedstawiają konformery etanu. Grube kresu oznaczają wiązania wysunięte do przodu, zwykłe są na płaszczyźnie rysunku, a przerywane oznaczają wiązanie wysunięte w tył. Niewielkiej rotacji uległ jeden wodór, jednakże to wystarczyłoby zmianie uległa cała struktura przestrzenna związku.
Izomeria geometryczna
Inaczej nazywana jest izomerią cis-trans lub izomerią E-Z. Związki mają identyczny skład oraz połączenia atomów, ale różne rozmieszczenia w przestrzeni.

Forma cis (Z) Forma trans (E)
Warunkiem występowania takiej formy jest obecność jednej lub dwóch par identycznych atomów lub grup atomów. Forma cis (Z) powstaje, jeżeli para identycznych atomów występuje po tej samej stronie płaszczyzny, natomiast forma trans (E), jeżeli para identycznych atomów występuje po przeciwnych stronach płaszczyzny.
Izomeria optyczna
W tym rodzaju izomerii izomery różnią się między sobą przestrzennym ułożeniem atomów lub grup atomów w cząsteczce. Przyczyną występowania tego typu izomerii jest brak symetrii cząsteczki. Spowodowane jest to najczęściej obecnością chiralnego (symetralnego) atomu węgla. Dzieli się ona na enancjomery oraz diastereoizomery. Enancjomery to izomery będące lustrzanymi odbiciami, a diastereoizomery to izomery nie będące lustrzanymi odbiciami.
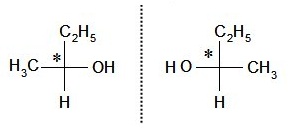
Enencjomer - butan-2-ol.
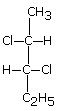
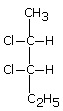
Diastereoizomery
Enancjomery to izomery będące lustrzanymi odbiciami, a diastereoizomery to izomery niebędące lustrzanymi odbiciami.
Źródła:
http://szkolnictwo.pl
http://www.chemorganiczna.com
http://open.agh.edu.pl/mod/resource/view.php?id=599
http://nauka.katalogi.pl/izomeria-t161.html
http://google.pl
http://wikipedia.org
http://nauka.katalogi.pl/izomeria-t161.html
http://portalwiedzy.onet.pl
Strona 4
Wyszukiwarka
Podobne podstrony:
Jak planować i organizować pracę z dziećmi o szczególnych potrzebach edukacyjnych, Szkoła- Porady pe
etyka-jak organizować pracę umysłową, Studia, etyka i filozofia
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
więcej podobnych podstron