0000027 4

Dla ścisłości należy zaznaczyć, że w obu wymienionych koenzymach część flawinowa nie może być uważana za nukleotyd, gdyż nie zawiera typowego dla tych związków wiązania N-glikozydowego (występuje tu rybitol zamiast rybozy). Pomimo to podane nazwy są powszechnie używane w piśmiennictwie.
Koenzymy flawinowe współdziałają z enzymami przenoszącymi atomy wodoru ze zredukowanego NAD+, czyli z reduktazami, łub w niektórych przypadkach - bezpośrednio z substratu, czyli z dehydrogenazami. Grupą czynną przy przenoszeniu protonów i elektronów jest układ izoalloksazyny, który odwracalnie może je przyłączać do atomów azotu w pozycjach 1 i 10, zgodnie z reakcją 6-6
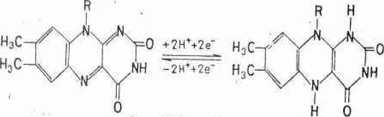
Przemiana formy utlenionej w zredukowaną jest związana z zanikiem żółtej barwy utlenionej flawiny, co znacznie ułatwia pomiar szybkości reakcji, podobnie jak to ma miejsce w przypadku nukleotydów niko-tynamidoadeninowych. Z żółtą barwą koenzymów flawinowych wiąże się jedna z nazw enzymów z nimi współdziałających, mianowicie żółte enzymy. Enzymy flawinowe, jak wspomniano, katalizują przeniesienie atomów wodoru z NADII + H+ (np. dehydrogenaza zredukowanego NAD+), czy NADPH + H+ (np. reduktaza azotanowa). Przyjęte przez układ flawinowy atomy wodoru są w dalszych reakcjach przekazywane na kolejne przenośniki tak zwanego łańcucha oddechowego i za ich pośrednictwem na tlen. Znane są również enzymy flawinowe, które odwodorowują substrat bezpośrednio, przekazując atomy wodoru na dalsze przenośniki (np. dehydrogenaza bursztynianowa lub mleczanowa drożdżowa), bądź bezpośrednio na tlen (np. oksydazy aminokwasowe, aminowe, oksydaza glukozowa lub ksantynowa). W przypadku bezpośredniego przeniesienia atomów wodoru z flawiny na tlen, produktem końcowym nie jest woda, lecz nadtlenek wodoru H202.
W przeciwieństwie do koenzymów nikolynamidoadeninowych, nukleotydy flawinowe są względnie mocno połączone z białkami enzymów i nie oddzielają się w czasie oczyszczania enzymów. Można je odwracalnie oddzielić przez traktowanie flawoproteidów rozcieńczonym kwasem'w niskiej temperaturze, co jest połączone z utratą aktywności przez enzym. Ponowne zmieszanie obu składników przywraca utraconą aktywność, jak to wykazał Theorell w 1934 r., przy czym była to pierwsza tego rodzaju udana próba rekonstrukcji enzymu.
Heminy komórkowe. Heminy, czyli związki o strukturze żelazoporfi-rynowej, występują jako niebiałkowe części składowe cytochromów, czyli chromoproteidów biorących udział w transporcie elektronów w łańcuchu oddechowym. Budowa grupy prostetycznej najlepiej poznanego cytochromu c przedstawia się następująco
128
Wyszukiwarka
Podobne podstrony:
img516 Dla ścisłości należy dodać, że rozporządzenie MOŚZNiL z dnia 30 grudnia 1996 r. w sprawie war
387 (14) - 387Tranzystor MIS Dla ścisłości należy dodać, że w tranzystorach z kanałem zubożanym możl
NoB 4 190 NAUKA O BOGU Osobą nie może być uważane za przypadłość Boga. Tomasza uderzyło jednak, że o
związane ze skalą czasu. Zdarzenie nie może być uważane za dokonane, dopóki wszystkie czyiuiości
FunkcjonowanieRynku R1278 379 nie, że formuła interwencjonizmu państwa na rynku nie może być stała.
skanuj0028 (81) Należy zaznaczyć, że podane w tabelach czasy przejazdu wyznaczone są dla grup jadący
Image15 Dla uproszczenia należy przyjąć, że - ulicą Pszczyńską nie jeździ tramwaj
Zdjęcie0134 (2) • Rozwój drożdży z rodzaju Należy zaznaczyć, że podręczniki winiarskie na ogół nie z
skanuj0010 (151) 160 7. Ruch turystyczny szym zakresie. Należy jednak zaznaczyć, że podział turystyk
img017 144 intensywnie świecić. Należy zaznaczyć, że jzorokość obrazu wady jest kilkakrotnie większa
więcej podobnych podstron