0000073 2

1
który wykazuje charakter enzymu — reduktazy. Za jego pośrednictwem elektrony są przenoszone na ferredoksynę (str. 227), która jest białkiem wykrytym również w chloroplastach, o masie cząsteczkowej 11 500 i — w przeciwieństwie do uprzednio opisanej — zawierającym dwa atomy żelaza nie związanego w hemie oraz dwie grupy SH. Ferre-doksyna — Fd wykazuje bardzo niski potencjał oksydoredukcyjny Eo — —0,42 V i tworzy układ oksydoredukcyjny ze wzglądu na zdolność odwracalnego przyłączania elektronów.
W systemie I, cyklicznym elektrony są dalej przekazane (przypuszczalnie za pośrednicwem FMN) na cytochrom b6, mający Eu’ = = —0,17, a następnie na cytochrom /, po czym poprzez plastocyjaninę, ponownie na chlorofil a (ściślej na barwnik P70o). Ponieważ przy przeniesieniu elektronów pomiędzy Cyt b6 i Cyt / różnica potencjałów AjE = 0,20 V, co odpowiada ok. 9000 cal, jest możliwe sprzężenie tej reakcji z wytworzeniem ATP według równania
ADP+ © -> ATP AGa = 8000 cal [14-3]
W systemie I obserwuje się znaczną analogię z procesem fosforylacji oksydacyjnej, biegnącej w sprzężeniu z łańcuchem oddechowym w mitochondriach. Dlatego też uważa się że mitochondria są tworami wtórnymi, ukształtowanymi z chloroplastów w drodze ewolucji na użytek komórek nie zdolnych do fotosyntezy. Mechanizm fosforylacji fotosyntetycznych w systemie I i II jest podany na rys. 89.
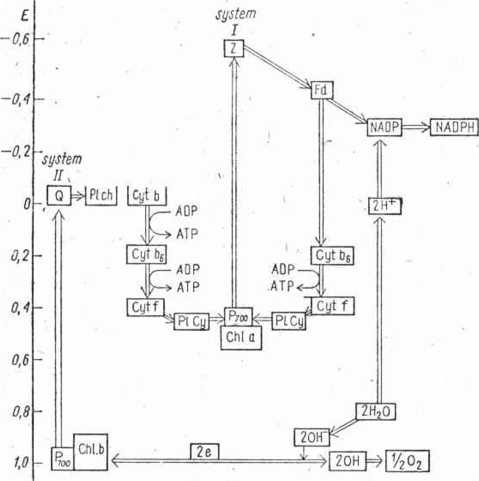
Rys. 89. Mechanizm fosforylacji fotosyntetycznych: I — niecyklicznej, II — cyklicznej; Chi a — chlorofil a, Chi b — chlorofil b, P,00 — barwnik absorbujący ekscitony, Q i Z — białka przenoszące elektrony, Fd — ferredoksyna, Plch — plastechinon, PICy — plastocyjanina, Cyt — cytochromy
317
Wyszukiwarka
Podobne podstrony:
BEATA BAJCAR kwestionariuszowych. Charakter i wyniki badań za pomocą tych metod są zróżnicowane. Spo
Bardzo ważnym zadaniem oprogramowania jest możliwość zdobycia za jego pośrednictwem pomocnych analiz
img404 (5) pamięci jego dziecka (?). Módl się za jego duszę”. Runy są źle rozmieszczone i niestarann
pójdą za jego przykładem, to pracownicy tylko na tym stracą. Dodać trzeba, że sytuacja ta najbardzie
yiSTULA GROUP SA - Informacje i objaśnienia do sprawozdania finansowego za 2014 rok Zapasy są wyceni
DSCN7153 (Kopiowanie) Biologia (zjawisko biegunowości), gdyż zawsze tylko na jednym jego końcu wytwa
Salon nie jest więc mieszkaniem, ale dziełem sztuki, a jego lokatorzy też są wystylizowani na upięks
ScannedImage 25 Musą ibn Nusajrem. Za jego rządów administrowanie tego rejonu sprawowano z Kajrawanu
Image51 (6) Schemat na rysunku 1 przedstawia układ, który służy jako ..oczy” do zabawki napędzanej s
20101214 142125 bmp Oto światopogląd, który przesądził o charakterze i kierunku myśli współczesnej.
65183 ScannedImage 25 Musą ibn Nusajrem. Za jego rządów administrowanie tego rejonu sprawowano z Kaj
~LWF0070 (3) 142 to jego koń Gullfaxi („złotogrzywy”), wsiadł na niego i ruszył galopem za Ody-nem,
więcej podobnych podstron