CCF20091206�017

Temperatura T=const
Wz PsV,
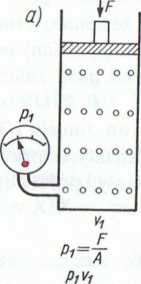
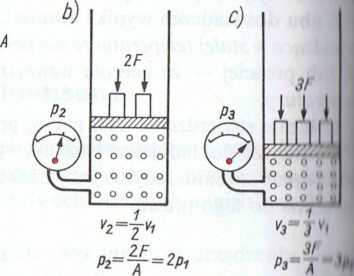
Rys. 3.2. Ilustracja prawa Boyle’a i Mariotte’a, czyli zaloż.liuf ciśnienia gazu od jego objętości w stałej temperaturze: ul i.ui
początkowy, b) i c) proporcjonalnie do wzrostu ciśnienia .....I< |»
objętość gazu
Ciśnienie p—const
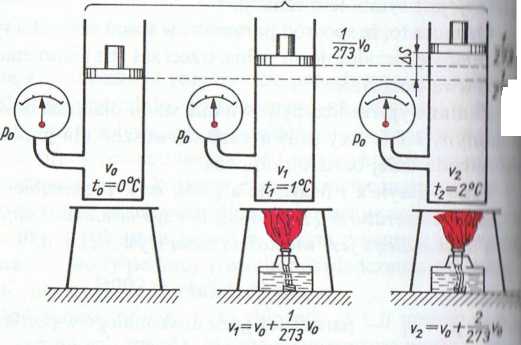
Rys. 3.3. Ilustracja prawa Gay-Lussaca. W miarę podgrzewania inin przy stałym ciśnieniu wzrasta jego objętość. Przesuwając ciężar (tli >11 m drodze ds, gaz wykonuje pracę
i ihi/m ciśnieniu stosunek wartości objętości właściwej gazu li ic n\'ch stanach jest równy stosunkowi jego temperatury, ftp/ ic skuli Kehiria
(3.3)
-L = 1l V2 T2
hm l lnuIcsa głosi, że przy stałej objętości stosunek wartości T/M iic u w dwóch różnych stanach jest równy stosunkowi jego tylut i' o skali Kelvina
Pi_
Pi
(3.4)
Pt iw* Av«gatira
'<#......Ungiidra głosi, że różne gazy doskonałe znajdujące się w tej
'Ni
Pl~p2
ti=tz
Vi=V2
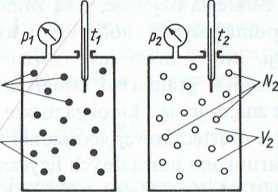
Rys. 3.4. Ilustracja prawa Avogadra
hMH|M'i ii turze i pod tym samym ciśnieniem w takiej samej H»i t >ii wiórują jednako->#la i /i|'ileczck.
Im uświadomić sobie Itniin |r wynikające Avogiulra (rys. 3.4),
||t |Mnl uwagę dwa róż-iM‘i iliwikoiiałe 1 i 2;
-i"/i»uy z /V, cząs-u Mianie cząsteczko-I, di ii(ii zań składający I A/, i /i|Nliii:zek o masie
%|»#|miwi'| M2. Masy obu gazów można wyrazić wzorami
m2 — N 2M 2
(3.5)
m, = NlM1;
........ It z wykorzystać zależność masy gazu od jego objętości V
|d .i r Wówczas otrzymamy następujące zależności
(3-6)
Keii m2 = V2Q
ImIi nim gazy znajdują się w jednakowych warunkach (px = p2 |t, i i zajmują taką samą objętość Vx = V2 = V, to — zgod-
Mit .• i.. linii /mi 49
Wyszukiwarka
Podobne podstrony:
1. Cel: doświadczalne wyprowadzenie prawa Boyle a - Mariotte a tzn. zależności pV = const. 2. Schema
10405784e355346139745016937834 n V. Przemiana Izotcrmiczna CEL Celem ćwiczenia jest doświadczalne sp
Rysunek pogodowy przyrządu do Sprawdzania prawa Boyle’a-Mariotte’a Ciśnienie p danej masy gazu w sta
image 015 Charakterystyka promieniowania 15 Rys. 1.2. Ilustracja graficzna zależności płaszczyzn: a)
image 016 16 Parametry anten Antena Rys. 1.4. Ilustracja graficzna możliwości uzyskania stałego pozi
image 043 Założenia wstępne - koncepcja strefy dalekiej 43 Rys. 2.3. Ilustracja graficzna pojęcia st
image 046 46 Fizyczne i wirtualne źródła pola promieniowania a) b) E , H i E* E . 7 H Rys. 2.4. Ilus
skrypt094 96 96 b)© WGf-/» ® G ) Gk——^-0 Rys. 5.6. Ilustracja polaryzacji indukowa
statystyka skrypt�64 bl Rys. 5.1. Ilustracja działania metody symplcksu w przestrzeni dwuwymiarowej,
img167 y x, x0 x Rys. 8.7 Ilustracja pojęcia poprawionej śr
skanuj0028 54 54 Rys.5. Ilustracja do twierdzenia Steinera 4.2. Twierdzenie Steinera Znając moment b
opis06 (2) Rys.6 Czoło wagonu gony BCi Wz.XIV drut 0,5mm Wz.XII poręcz drut 1mm 8 szt. 9 Wz.XII Rys.
skrypt021 ZH ttozaziai u. rroces promowania, Tc -O x{kTs) T.TT /. = 1/TS sygnał dyskretny Rys. 3.1.
więcej podobnych podstron