Samsung SCX 6x22 Series 091118164846 1

wzrasta od 2 do 4 razy, co nożna zapisać wzorem
W
s
kT + 10 • ^T
(1.18)
gdzla: ky - stała szybkości reakcji w temp. T;
kT>1Q- stała szybkości reakcji w temp. T+10.
Dokładniej zależność stałej szybkości reakcji k od tempera* tury charakteryzuje równanie Arrheniusa
(1.19)
log k ■ H - 2 T
gdzie: H i a - wartości stałe, charakterystyczne dla danej reakc T - temperatura.
Stała a zawiera czynnik energetyczny reakcji chemicznej
8 * 27353”R (1.20)
gdzie: R - uniwersalna stała gazowa;
2,303 - współczynnik prze liczeniowy ln na log.
Stała Eg nazywa się energię aktywacji 1 charakteryzuje energię, Jakę muszę aleć reagujęce częstki (w przeliczeniu na 1 mol zespołów reakcyjnych aktywnych), aby zde-rżenia między nimi były efektywne.
Przebieg reakcji chemicznej można najogólniej zilustrować na przykładzie
AB
(1.21)
A + B
W wyniku efektywnego zderzenia częstek A z częstkami B powstaje przejściowy zespół reakcyjny aktywny [A-Bl* o czasie trwania od 10 do 10 sekundy. Aby taki zespół utworzył się musi być pokonana bariera energetyczna równa energii aktywacji danej reakcji. Zespół reakcyjny aktywny ulega rozpadowi, w wyniku którego powstaję produkty reakcji, w omawianym przykładzie częstka AB lub ponownie substraty reakcji. Przemiany energetyczne zecho-dzęce w czasie biegu reakcji egzotermicznej i endotermiczneJ zilustrowane sę na rys.1.la i b.
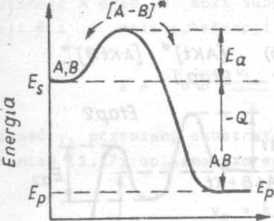
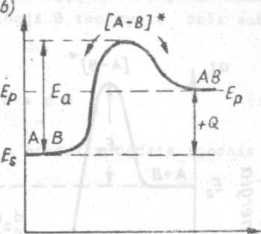
PARAMETR BIEGU REAKCJI
Rys.1.1. Przemiany energetyczna w czasie biegu reakcji chemicznej i
a) reakcja egzotermicznat b) roakcjs enrtoter-mlczna
Szybkość reakcji chemicznych można znacznie zwiększeń łub zmniejszać przez zastosowanie katalizatorów, Koteliza-torem nazywamy substancję, która bierze udział w etapach elementarnych reakcji, nie wchodzi jednak w skład produktów reakcji, a po jej zakończeniu masa jego pozostaje niezmieniona.
De Ze li katalizatory zwiększają szybkość reakcji, nazywamy js katalizatorami dodatnimi, jeżeli Ję zmniejszaj? -
ujemnymi lub inhibitorami. Działanie katalizatorów polega na obniżaniu energii aktywacji na skutek zmiany mechanizmu reakcji. Schematycznie zmiany energii aktywacji reakcji z udziałem katalizatora zilustrowane sę na rys.1.2.' Rozpatrzmy reakcję
A + B * AB (1.22)
Reakcja ta bez katalizatora wymaga określonej energii aktywacji (rys.1.2). W obecności katalizatora reakcja ta może przebiegać dwuetapowo:
- etap 1: A K t ■ [AKt J * ♦AKt *^al
- etap 2: AKt ♦ 8 - [AKtB]* -mAB ♦ Kt, ć#2
9$ niższe
przy czym energie aktywacji etapów 112, E#1 i £a2 od energii aktywacji reakcji bez katalizatora E#.
Wyszukiwarka
Podobne podstrony:
Samsung SCX 6x22 Series 091118165128 1 6) Oak rozumiesz sten równowagi chemicznej
Samsung SCX 6x22 Series 091118164709 1 Oparzenia w przypadku lżejszych oparzeń skóry, wywołanych pło
Samsung SCX 6x22 Series 091118164751 1 informuje nas, że 1 mol węgla (2.2 g) reaguje z 1 molem tlenu
Samsung SCX 6x22 Series 091118164822 1 niania 1 r e d u k c J 1 , np. q a &n
Samsung SCX 6x22 Series 091118164909 1 Rys.1.2. Zmiany anergll w czasie biegu reakcji egzotermicznej
Samsung SCX 6x22 Series 091118164934 1 ćowane sę Jedynie zmianami stężeń reagujących substancji. Po
HPIM5191 i właściwościach użytych tworzyw przenosi od 1,5 do 1,7 razy większe obciążenia. Ponadto, p
- 51 ęr-bośd od 0,4 do 2 nun co 0,05 m, od 2,0 do 31 26 mm co 0,1 mmi szerokość od 30 do 100 mm co 2
str 57,58 Skorupa kontyncntitlnn (5+60 km) od 5 do 60 km, a skorupa oceaniczna od 0,5 do 5 km, co w
DSCF5537 249 6. Owies Owies jest mało wrażliwy na odczyn gleby w zakresie pH od 4,5 do 7,2 (rys. 5.9
połącz punkty 63. Połącz linia wszystkie punkty od 1 do 20. Co otrzymałeś?V_________1_y
choroszy05 305 150 do 300 mm/min. Wydajność frezowania jest przy tym od 2 do 3 razy większa niż
43893 zad23 Przykład 4.5. Dana jest wzrastająca liniowo w przedziale od a do b dystrybuan-ta zmienne
41183 Okres przedszkolny 4 6 ogółem Załącznik 3 Okres przedszkolny (obejmuje okres od 4 do końca 6 r
228 2 4. TURBINY PAROWE zmiana mocy całkowitej turbozespołu A P nie wzrasta od razu do pełnej wartoś
więcej podobnych podstron