338
A HibUl. IM1U.1 .Vvu r„, r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS >*}
333 11 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW KWASY I ZASADY
Gdybyśmy więc znali np. AW<Na*). można by z różnic entalpii hydratacji szeregu chlorków obliczyć entalpię hydratacji kationów, a następnie anionów.
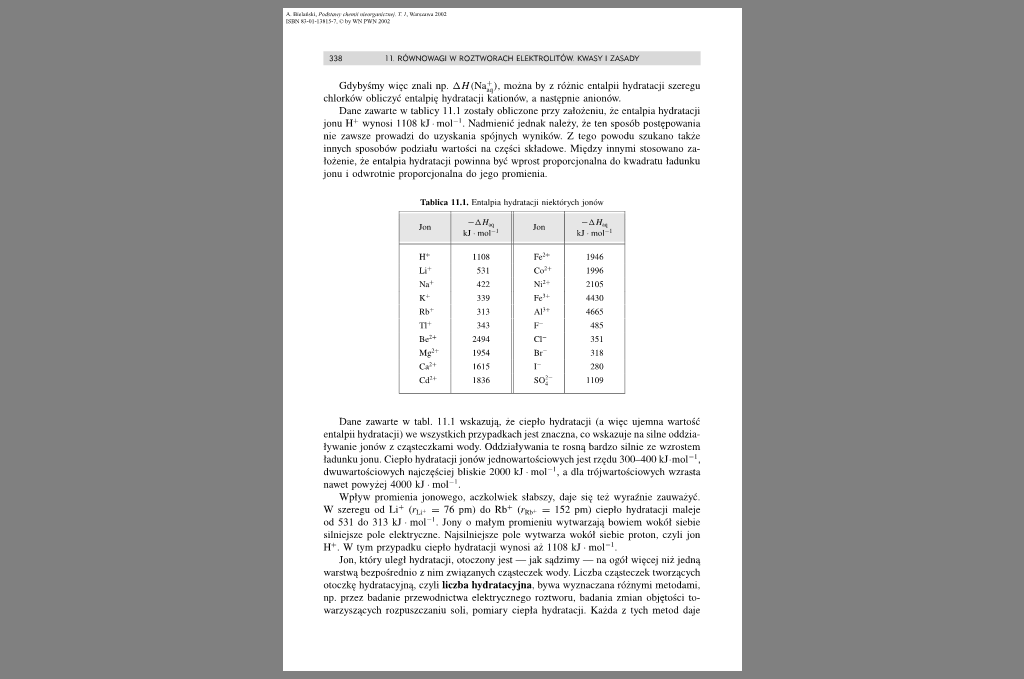
Dane zawarte w tablicy 11.1 zostały obliczone przy założeniu, że entalpia hydratacji jonu H* wynosi 1108 kj mol '. Nadmienić jednak należy, że ten sposób postępowania nic zawsze prowadzi do uzyskania spójnych wyników. Z tego powodu szukano także innych sposobów podziału wartości na części składowe. Między innymi stosowano założenie, że entalpia hydratacji powinna być wprost proporcjonalna do kwadratu ładunku jonu i odwrotnie proporcjonalna do jego promienia.
Tablica 11.1. llnlatpia hyilr.tL&:ii niektórych jonów
|
Jon |
-AH., kJ mol 1 |
Jon |
-AJ/„ kJ mol-' |
|
H' |
MOS |
Fe" |
19-16 |
|
Li* |
531 |
Co" |
1996 |
|
Na' |
422 |
Ni1* |
2105 |
|
K- |
339 |
Fe’* |
4430 |
|
Rb* |
313 |
Al" |
4665 |
|
Tl* |
343 |
F- |
4X5 |
|
De** |
2494 |
a- |
351 |
|
Mg'* |
1954 |
Br’ |
318 |
|
cv* |
1615 |
1- |
2X0 |
|
Cd!* |
IS36 |
so! |
1109 |
Dane zawarte w tabl. 11.1 wskazują, ze ciepło hydratacji (a więc ujemna wartość entalpii hydratacji) we wszystkich przypadkach jest znaczna, co wskazuje na silne oddzia ływanic jonów z cząsteczkami wody. Oddziaływania tc rosną bardzo silnie ze wzrostem ładunku jonu. Ciepło hydratacji jonów jcdnowartościowych jest rzędu 300-400 kJ mol \ dwu wartościowych najczęściej bliskie 2000 kJ mol a dla trójwartościowych wzrasta nawet powyżej 4000 kJ mol 1.
Wpływ promienia jonowego, aczkolwiek słabszy, daje się też wyraźnie zauważyć W szeregu od U* (rjj. — 76 pmt do Rb* = 152 pm) ciepło hydratacji maleje od 531 do 313 kJ mol Jony o małym promieniu wytwarzają bowiem wokół siebie silniejsze pole elektryczne. Najsilniejsze pole wytwarza wokół siebie proton, czyli jon II'. W tym przypadku ciepło hydratacji wynosi az 1108 kJ mol-1.
Jon. który uległ hydratacji, otoczony jest — jak sądzimy — na ogól więcej niż jedną warstwą bezpośrednio z mm związanych cząsteczek wody. Liczba cząsteczek tworzących otoczkę hydraiacyjną, czyli liczba hydralacyjna. bywa wyznaczana różnymi metodami, np. przez badanie przewodnictwa elektrycznego roztwx>ru. badania zmian objętości towarzyszących rozpuszczaniu soli. pomiary ciepła hydratacji Każda z tych metod daje
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« rw, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 18
A HibUl. IM1U.1 ,Vv»« raa, r ), buui :uO ISBN D4H1II ł-7. © t>< WN TOS >«
A HibUl. IM1U.1 .Vvu r.., r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 34
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2
A HibUl. IM1U.1 .Vvu r„, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 1.4
A HibUl. IM1U.1 .Vvu .«n>v>».--u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 2 2 EN
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 a SZY
A HibUl. IM1U.1 ,Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 37
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 40 2
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 1
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3 1 DWO
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 2 ZAS
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-Ż © l>. »N TOS »*} 3.2 ZASADA
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 54 3
więcej podobnych podstron