ScannedImage 9
Izolacja kwaśnej fosfatazy z nasion łubinu
2g mąki otrzymanej przez zmielenie nasion łubinu zalewa się porcjami 20 ml buforu ekstrakcyjnego i uciera się w moździerzu w temperaturze pokojowej przez 10 min. Następnie wirujemy po zrównoważeniu w wirówce K-24 przy 10 tys. obrotów przez 10 min. Po odwirowaniu osad odrzucamy, a supematant służył nam będzie jako źródło kwaśnej fosfatazy.
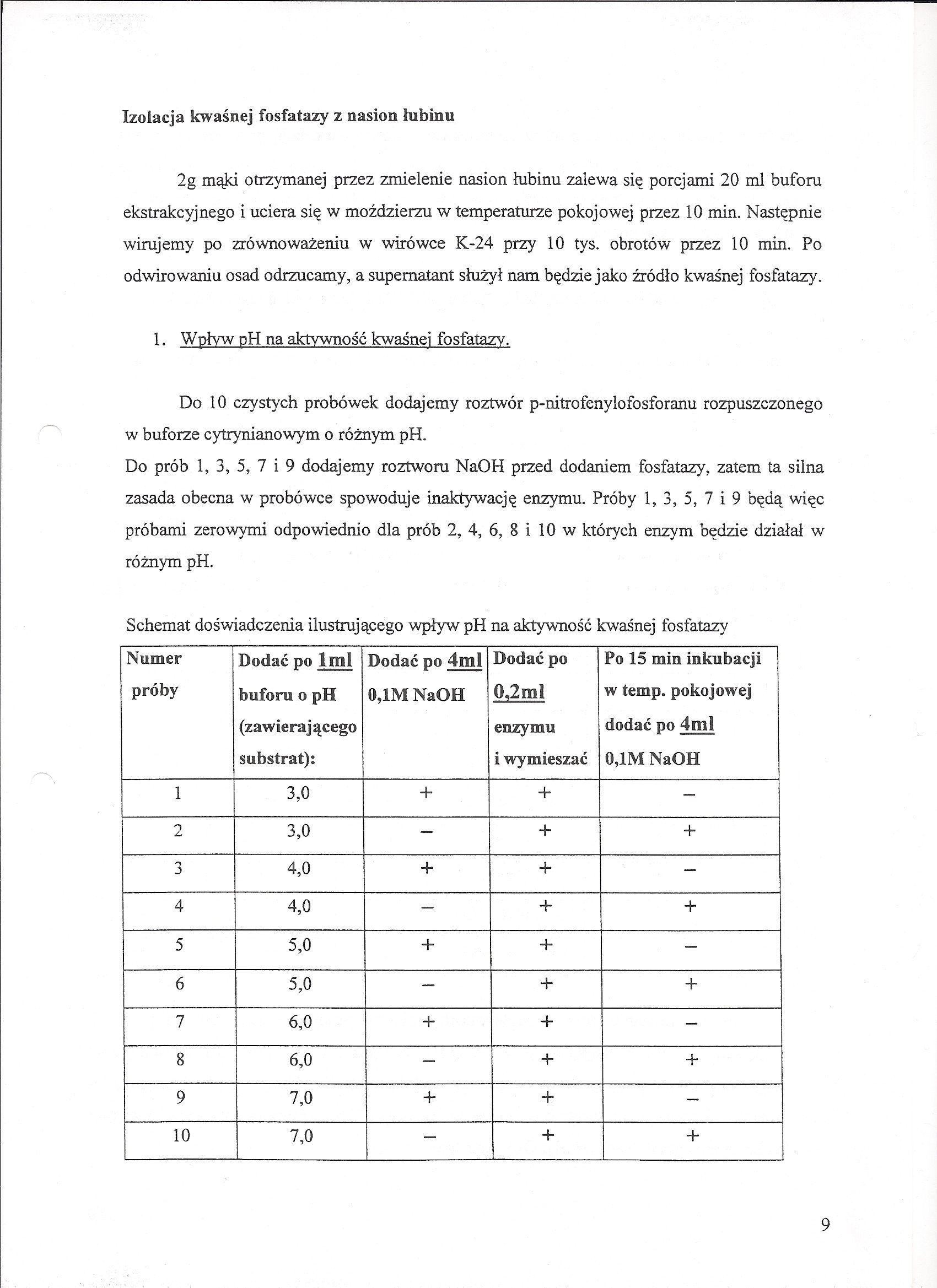
1. Wpływ pH na aktywność kwaśnej fosfatazy.
Do 10 czystych probówek dodajemy roztwór p-nitrofenylofosforanu rozpuszczonego w buforze cytrynianowym o różnym pH.
Do prób 1, 3, 5, 7 i 9 dodajemy roztworu NaOH przed dodaniem fosfatazy, zatem ta silna zasada obecna w probówce spowoduje inaktywację enzymu. Próby 1, 3, 5, 7 i 9 będą więc próbami zerowymi odpowiednio dla prób 2, 4, 6, 8 i 10 w których enzym będzie działał w różnym pH.
Schemat doświadczenia ilustrującego wpływ pH na aktywność kwaśnej fosfatazy
|
Numer próby |
Dodać po lmł buforu o pH (zawierającego substrat): |
Dodać po 4ml 0,IM NaOH |
Dodać po 0,2ml |
Po 15 min inkubacji w temp. pokojowej dodać po 4ml 0,1M NaOH |
|
enzymu i wymieszać | ||||
|
1 |
3,0 |
+ |
+ |
- |
|
2 |
3,0 |
- |
+ |
+ |
|
3 |
4,0 |
+ |
+ |
- |
|
4 |
4,0 |
- |
+ |
+ |
|
5 |
5,0 |
+ |
+ |
- |
|
6 |
5,0 |
- |
+ |
+ |
|
7 |
6,0 |
+ |
4- |
- |
|
8 |
6,0 |
- |
+ |
+ |
|
9 |
7,0 |
+ |
+ |
- |
|
10 |
7,0 |
- |
+ |
+ |
9
Wyszukiwarka
Podobne podstrony:
KINETYKA REAKCJI ENZYMATYCZNYCH Wyznaczanie stałej Michaelisa (KM) na przykładzie kwaśnej fosfatazy
ScannedImage 9 roślin strączkowych. Namoczone nasiona soi należy zalać świeżą, zimną wodą, podczas g
ScannedImage 8 V Wykonanie ćwiczenia Fosfatazy są grupą enzymów szeroko rozpowszechnioną zarówno w ś
C. Badanie wpływu stężenia substratu na aktywność katalityczną kwaśnej fosfatazy. Wyznaczanie stałej
Marana HW*»kĆwiczenie laboratoryjne 7 Charakterystyka kwaśnej fosfatazy z homogenatu ziemniaka OŚ—
C. Badanie wpływu stężenia substratu na aktywność katalityczną kwaśnej fosfatazy. Wyznaczanie stałej
kwaśnej, fosfatazy zasadowej, adenozynotrójfosfatazy oraz dehydrogenazy mleczanowej, dehydrogenazy
ScannedImage 12 126 O W IDO ZLATKES Wiatr i burza tworzą ich substancję (Ps 148,8)- Burza opiera się
Kwaśne deszcze są to opady atmosferyczne o kwaśnym odczynie. Powstają w wyniku połączenia znajdujący
Untitled Scanned 45 C 1.10 Ćwiczenie umiejętności ortograficznych Wyrazy ze zmiękczeniami przez „i&q
więcej podobnych podstron