294

A r ). (Uimm 2U&
KW rmhni v>. o ty un rws w:
9 TERMOCHEMIA
Odejmując stronami drugie równanie tcrmochcmicznc od pierwszego, znajdujemy, że
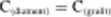
AH" = A W," A H~ = 395.40-(-393.50) = -1.90 kJ moł '
Przeprowadzenie takiego obliczenia jest równoznaczne z. zsumowaniem entalpii dwóch kolejnych procesów: spalenia diamentu na CO: oraz rozłożenia CO: na grafit i tlen. Bilans obu tych reakcji sprowadza się do przemiany diamentu w grafu
9.5. STANDARDOWE ENTALPIE TWORZENIA ZWIĄZKÓW CHEMICZNYCH
Wielkościami pozwalającymi na dokonywanie obliczeń entalpii różnych pomyślanych reakcji chemicznych są standardowe entalpie tworzenia związków chemicznych z pierwiastków. AH*. Standardowe entalpie tworzenia związków z pierwiastków w niektórych przypadkach mogą być wyznaczone bezpośrednio na podstawie pomiarów kalorymetrycznych, np. entalpię tworzenia MgO możemy wyznaczyć spalając metaliczny magnez w bombie kalorymetrycznej. Jeżeli temperatura na początku i na końcu doświadczenia będzie równa 298.15 K, to zmierzony efekt cieplny odnosić się będzie do tej właśnie temperatury niezależnie od temperatury, jaka panowała w bombie w chwili spalania metalu. Bomba kalorymetryczna jest naczyniem o stałej objętości, ciepło q, wydzielone w czasie spalania magnezu w tych warunkach odpowiada pizeto zmianie energii wewnętrznej
Mg 4- 10, = MgO Al/,; = —600.29 kJ mol 1 W celu oblicz.cnia entalpii lej reakcji musimy się pusłuż.yć równaniem (9.10)
</<■ = A/C = 9. + /'Al'
W czasie prowadzenia tej samej reakcji pody stałym ciśnieniem nastąpiłaby w razie spalenia I mola atomów magnezu zmiana objętości o objętość 1/2 mola cząsteczek gazu. to jest o Au = —RT/{2p):
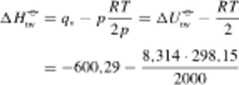
= -600.29 1.24 = -601.53 kJ
Najczęściej jednak wartości A są obliczane z wartości entalpii uzyskanych z bezpośredniego pomiaru dla kilku innych odpowiednio dobranych reakcji. Na przykład entalpie tworzenia metanu, A//,®CHi możemy obliczyć na podstawie entalpii spalania metanu, węgla w postaci gratilu oraz wodom
Aff* = -393.5 kJ mor* A//r m -285.8 kJ mol’' A/C - -890.4 kJ mor'
Cenili + O;,,, — CO,,j,
H:U, + lO:iJ) - H:0,„
CHł,,-. + 202„i - COw. + 2H;0.
Wyszukiwarka
Podobne podstrony:
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 16 1 PODSTAW
A r J. (Uimm 2U& KW rmhni v>. o ty un rws w: 10z 3 ELfKTR
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 4 4 HCWOJĄDRCrtE CZĄSTECZKI DW
A r J. (Uimm 2U& KW rmhni v>. o ty un rws w: 4 7 WIĄZANIA POŚREDNIE POMIĘDZ
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 224 7 CIAŁO
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 378 12 UTLEN
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 3% 13 zjawis
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 408 13 ZJAWI
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 14 2 PROSTE REAKCJE JEDNO-, DW
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 418 U KINETY
A r /. (Uimm 2U& KW rmhni v>. o ty un rws w: 468 15 ZWIĄZ
A r ). (Uimm :t«u KW rmhni v>. o ty un rws w: 340 11 RÓWNOWAG
A r J. (Uimm :t«u KW rmhni v>. o ty un rws w: 4 1 PODSTAWOWE
A r ). (Uimm :t«u KW rmhni v>. o ty un rws w: 8 1 PODSTAWOWE
A r ). (Uimm :t«u KW rmhni v>. o ty un rws w: U 1 PODSTAWOWE
A r J. (Uimm :t«u KW rmhni v>. o ty un rws w: 24 2 iĄDRO ATOMOWE W podobny spos
A r ). (Uimm :t«u KW rmhni v>. o ty un rws w: 36 2. JĄDRO ATO
więcej podobnych podstron