2

110 Enzymy
enzymy, katalizujące sprzężone ze sobą reakcje chemiczne, występują w organizmach w formie kompleksów wieloenzymowych.
Charakterystyczną cechą enzymów jest obecność w ich strukturze tzw. centrum aktywnego (Rys. 4.2). Jest to obszar cząsteczki, biorący udział w wiązaniu substratów i ich swoistym przekształcaniu. Grupy funkcyjne aminokwasów tworzących centrum aktywne zwykle nie należą do aminokwasów zajmujących kolejne miejsca w liniowej sekwencji łańcucha polipeplydowego. Pochodzą one od reszt aminokwasów niekiedy znacznie oddalonych, sąsiadujących ze sobą wskutek określonego przestrzennego ukształtowania łańcucha białkowego.
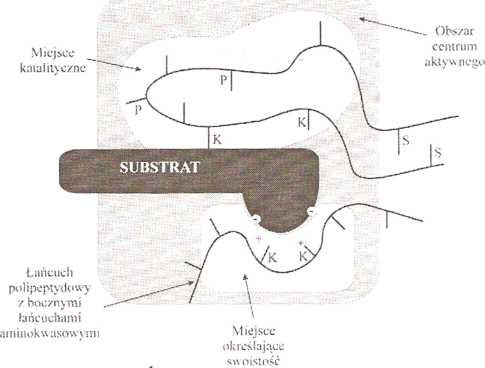
K. - aminokwas kontaktowy P •• aminokwas pomoenio/y S - aminokwas stabilizujący
Rys. 4.2 Budowa centrum aktywnego wg Koshlanda
W centrum aktywnym można wyróżnić grupy aminokwasów pełniących różne role w katalizowanym procesie, są to:
aminokwasy kontaktowe, których jeden lub więcej atomów jest oddalony od substratu na odległość odpowiadającą przeciętnej długości wiązania chemicznego; należą do nich aminokwasy wiążące substrat oraz biorące bezpośredni udział w katalizie aminokwasy pomocnicze, które nie stykając się z substratem, pełnią jednak określona rolę w czynności katalitycznej enzymu, właściwie orientując substrat Oprócz aminokwasów tworzących centrum aktywne, w cząsteczce enzymu występują aminokwasy stabilizujące jego strukturę przestrzenną oraz aminokwasy nie biorące udziału w stabilizacji budowy przestrzennej ani w funkcji katalitycznej. W obszarze centrum aktywnego wyróżnia się miejsce wiązania substratu, czyli miejsce określające specyficzność enzymu oraz miejsce katalityczne, czyli miejsce, w którym zachodzi katalizowana reakcja.
Specyficzność wiązania substratu przez enzym zależy od precyzyjnie określonego ułożenia atomów w miejscu aktywnym. Substrat musi mieć odpowiedni kształt, by mógł pasować do miejsca aktywnego. Model E. Fischera zakłada, że kształt miejsca aktywneac
Wyszukiwarka
Podobne podstrony:
4. Enzymy Enzymy to katalizatory reakcji chemicznych zachodzących w organizmach żywych. W ich obecno
ENZYMY • są katalizatorami, które zwiększają szybkość reakcji chemicznej •
22064 WYKŁAD 2 enzymy cz 1 (19) Enzymy nie zmieniają stanu równowagi reakcji chemicznejA + B <
70057 SDC10466 Enzymy wpływają na przebieg określonych reakcji chemicznych w organiz-mach żywych, ch
0000028(1) want ci r A/ł Zad. 32. Wykaż, żc w przypadku pary genów sprzężonych ze sobą, krzyżówki wy
Zdjęcie0631 Układ kontrolny regulujący oddychanie składa się z kilku sprzężonych ze sobą komponentów
DSC03335 (2) 108109 Ponieważ zasób zbudowany jest strukturalnie z pewnej liczby sprzężonych ze sobą
(_ OtKZy MYWANIE POUM0KÓW 1 Mono = substancja, której cząsteczki łączą się ze sobą w reakcji
Kamery stereometryczne - dwie sprzężona ze sobą na stałe w odleglości40 lub 120 cm, średnioformatowe
eksp5 ekstrudowanie — dzięki sprzężeniu ze sobą dwóch ekstruderów w linii produkcyjnej albo użycie e
eksp5 ii ekstrudowanie — dzięki sprzężeniu ze sobą dwóch ekstruderów w linii produkcyjnej albo użyci
więcej podobnych podstron