350
A HibUl. IM1U.1 .Vvu r ), buui :uO
ISBN D4H1II ł-7. © by »N TOS »*}
350 11 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW KWASY I ZASADY
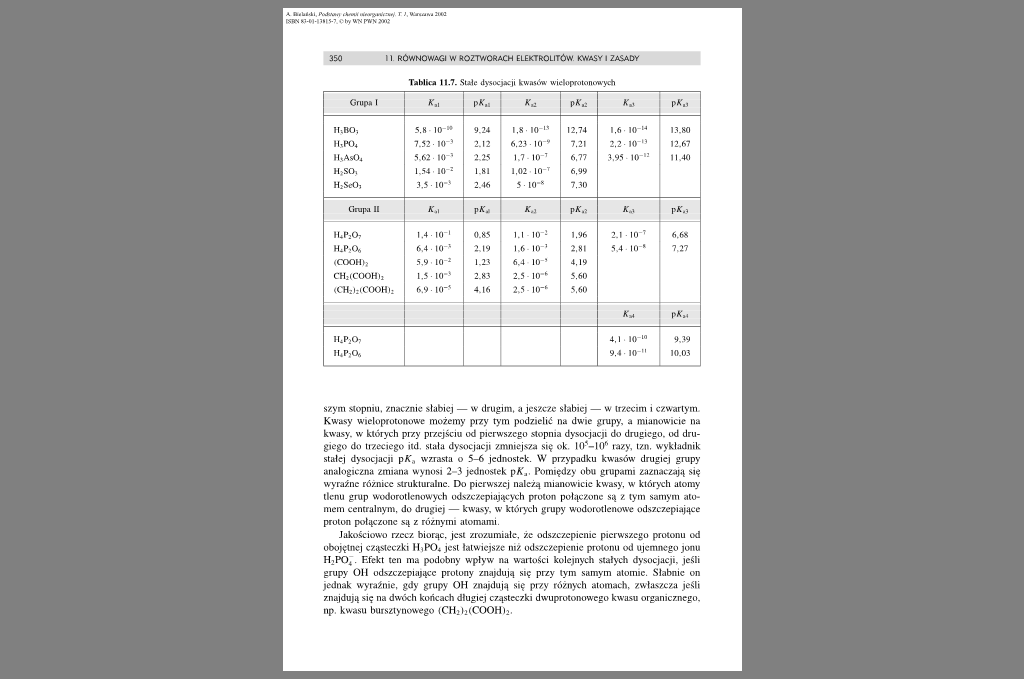
Tablica 11.7. Siak ilysocjacji kwasów wicloprotomiwydi
|
Grup* 1 |
pAT., |
pATo |
ATo |
pATo | ||
|
It-.BOi |
5.8 10 *♦ |
9.24 |
1.8 10-'* |
12.74 |
1.6 10w |
13.80 |
|
IhPO* |
7.52- 10-’ |
2.12 |
6.23-I0-V |
7.21 |
2.2-10-” |
12.67 |
|
IhAsO, |
5.62 10-’ |
2.25 |
1.7-10"’ |
6.77 |
3.95 10-" |
11.40 |
|
HjSO, |
1.54 10 : |
1.81 |
1.02 I0T |
6.99 | ||
|
H;StOi |
3.5 10-* |
2.46 |
5•10-* |
7.30 | ||
|
Gmpa 11 |
^1 |
pATa |
K., |
pAf.i |
a:,. |
pAT.> |
|
łLP.Or |
1.4-10"' |
0.85 |
1.1 I0': |
1.96 |
2.1 -I0‘7 |
6.68 |
|
H.P.O* |
6.4 • IO-ł |
2.19 |
1.6 10 ’ |
2.81 |
5.4 I0-* |
7.27 |
|
(OOOHk |
5.9 10-ł |
1,23 |
6.4 10-’ |
4.19 | ||
|
CHjtCOOHli |
1.5 -10-' |
2.83 |
2.5 - lO'* |
5.60 | ||
|
<CH*):(COOHk |
6.9 10-' |
4.16 |
2.5 10'* |
5.60 | ||
|
ar- |
r*„ | |||||
|
ll4P>0? |
4.1 10 10 |
9.39 | ||||
|
H4P;On |
9.4 10" |
10.03 |
szym stopniu. znacznie słabiej — w drugim, a jeszcze słabiej — w irzceim i czwartym Kwasy wieloprotonowc możemy przy tym podzielić na dwie grupy, a mianowicie na kwasy, w których przy przejściu od pierwszego stopnia dysocjacji do drugiego, od drugiego do tizeciego itd. siała dysocjacji zmniejsza się ok. I0'-HV' razy, izn. wykładnik stałej dysocjacji pAf., wzrasta o 5-6 jednostek. W przypadku kwasów drugiej grupy analogiczna zmiana wynosi 2-3 jednostek pKj. Pomiędzy obu grupami zaznaćzają się wyraźne różnice strukturalne. Do pierwszej należą mianowicie kwasy, w których atomy tlenu grup wodorotlenowych ud-szczcpiających proton połączone są z tym samym atomem centralnym, do drugiej — kwasy, w których grupy wodorotlenowe odszezcpiające proton połączone są z różnymi atomami.
Jakościowo rzecz biorąc, jest zrozumiałe, że odszczcpicnic pierwszego protonu od obojętnej cząsteczki IItP04 jest łatwiejsze niż odszczcpicnic protonu od ujemnego jonu H.PO,. F.fckt ten ma podobny wpływ na wartości kolejnych stałych dysocjacji. jeśli grupy Oli odszezcpiające protony znajdują się przy tym samym atomie. Słabnie on jednak wyraźnie, gdy grupy OH znajdują się przy różnych atomach, zwłaszcza jeśli znajdują się na dwóch końcach długiej cząsteczki dwuprołonowego kwasu organicznego, np kwasu bursztynowego tCH>l;(COOHij.
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II t-7. © by »N TOS >«} 12
20 A HibUl. IM1U.1 .Vvu .•»•»»«.--u, r ), buui :uO ISBN D4H1II t-7. © by »N TOS »*} 2 iĄDRO
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 69 3 5 OftB
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 3 13 WŁAŚCI
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 5 4 CHARAKT
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 7 CIAŁO
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 7 9 SIECI PRZE
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II t-7. © by »N TOS >*} 226 7 CIAŁO
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 7 12 TEORIA
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 7 15 W
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 370
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 484 15 2W1
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 48JŚ 15 2W
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © by »N TOS »*} 502 15 2W1Ą2KI
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II *?. © by »N TOS »*} 15 13 ZASTO
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © by WN TOS »*}64 &n
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II t-7. © by WN TOS >*} 130
A HibUl. IM1U.1 .Vv»i r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >*} 118
A HibUl. IM1U.1 .Vv»i r.., r ), buui :uO ISBN D4H1II ł-7. © by »N TOS >«} 120
więcej podobnych podstron