skanuj0016 (96)

457
14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej
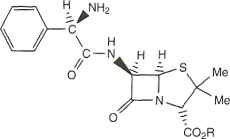
grupę aminową. Rozwiązaniem jest stosowanie proleku, w którym jedna z polarnych grup jest zamaskowana ugrupowaniem zabezpieczającym. Po zaabsorbowaniu proleku przez ściany jelit, ugrupowanie to jest usuwane w wyniku metabolizmu. Trzy przykłady takich proleków przedstawiono na rys. 14.37.
o
ii
R=|-CH20 CMe3 O
r §
PIWAMPICYLINA
TALAMPICYLINA
f „CL
R= j-CH-0 0-CH2Me BAKAMPICYLINA
Rysunek 14.37. Proleki pomagające w absorpcji penicylin przez ściany jelit
Wszystkie te trzy związki są prolekami ampicyliny. Grupa karboksylowa jest w nich zablokowana bardzo rozbudowanym ugrupowaniem estrowym. Można by zadać pytanie: dlaczego nie wprowadzono prostego estru metylowego? Odpowiedź jest prosta: otóż estry metylowe penicylin nie ulegają metabolizmowi w organizmie ludzkim. Prawdopodobnie szkielet układu penicyliny znajduje się zbyt blisko grupy estrowej, co chroni ją przed dostępem esteraz.
Stwierdzono, że na szczęście estry acyloksymetylowe są podatne na działanie niespecyficznych esteraz. Takie „wydłużone” estry zawierają daleko od rdzenia penicyliny drugie ugrupowanie estrowe, które jest bardziej podatne na atak esteraz. Powstające produkty hydrolizy są nietrwałe i ulegają spontanicznemu rozkładowi z uwolnieniem wolnej grupy karboksylowej (rys. 14.38) i formaldehydu. Powstawanie formaldehydu nie jest korzystne, ponieważ jest to związek toksyczny. Tworzy się on jednak w ustroju w wyniku enzymatycznej demetylacji różnych związków pochodzących z pożywienia, tak że jego ilość uwalniana z leków, takich jak penicylina, jest niewielkim problemem, ponieważ leki te stosuje się krótko.
H©
;c~o-ch2-o'
CMe3
ENZYM
//
i
Formaldehyd
Rysunek 14.38. Rozkład estrów acyloksymetylowych
Wyszukiwarka
Podobne podstrony:
skanuj0020 (74) 461 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej ryny mogą s
skanuj0024 (57) 465 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej •
skanuj0028 (48) 469 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej Lek ten jes
74431 skanuj0004 (254) 445 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej i i
skanuj0002 (269) 443 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej W 1928 rok
27165 skanuj0010 (165) 451 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej Wraż
skanuj0008 (186) 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej 449 atomie
29569 skanuj0022 (64) 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej 463 kznyc
85780 skanuj0030 (41) 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej Otrzymano
więcej podobnych podstron