27165 skanuj0010 (165)

451
14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej
Wrażliwość penicylin na (3-laktamazy
P-Laktamazy są enzymami wytwarzanymi przez bakterie penicylinoopome; mogą one katalizować reakcję przedstawioną na rys. 14.30, np. otwarcie pierścienia i unieczynnienie penicyliny, co następuje w przypadku kwaśnej hydrolizy.
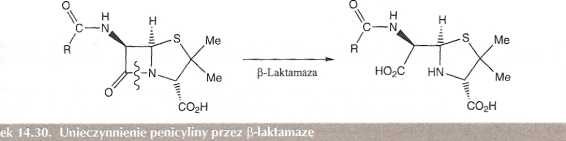
Problem aktywności p-laktamazy stał się bardzo poważny w 1960 roku, kiedy powszechne stosowanie penicyliny G spowodowało alarmujący wzrost infekcji wywołanych gronkowcem złocistym (Staphylococcus aureus). U tych kłopotliwych szczepów pojawiła się laktamaza i z tej przyczyny nabrały one oporności na lek. Doszło już do sytuacji, że 80% wszystkich infekcji gronkowcowych w szpitalach było spowodowanych przez szczepy penicylinoopome. Alarmująca była oporność tych szczepów na wszystkie inne dostępne antybiotyki.
Na szczęście rozwiązanie tego problemu „stało za rogiem”, a było nim projektowanie penicylin odpornych na penicylinazę. Powiedzieliśmy: projektowanie, co sugeruje, że zastosowano pewien rodzaj planu przeciwstawiającego się skutkom działania penicylinazy.
Jak więc poradzono sobie z tym problemem?
Zmaganie się z wrażliwością p-laktamazy
Strategia polegała na zablokowaniu penicyliny, zanim osiągnie miejsce aktywne penicylinazy. Jednym ze sposobów jest umieszczenie dużej grupy w łańcuchu bocznym. Ta duża grupa może działać jak „zasłona” odpędzająca penicylinazę i w ten sposób zapobiegająca wiązaniu (rys. 14.31).
Uzyskano kilka analogów i stwierdzono, że taka strategia jest skuteczna. Był jednak problem. Jeśli boczny łańcuch był zbyt duży, to steryczna „zasłona” uniemożliwiała penicylinie atak na enzym odpowiedzialny za syntezę ściany komórkowej bakterii. Tak więc trzeba było wykonać dużą pracę, aby znaleźć idealną „zasłonę” — wystarczająco dużą dla odparcia laktamazy i na tyle małą, aby penicylina mogła wykonywać swoje zadania. Oddziaływanie pierścienia p-laktamu z obydwoma enzymami potęgowało stopień trudności w poszukiwaniu idealnej „zasłony”.
Wyszukiwarka
Podobne podstrony:
skanuj0020 (74) 461 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej ryny mogą s
skanuj0024 (57) 465 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej •
skanuj0028 (48) 469 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej Lek ten jes
skanuj0016 (96) 457 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej grupę amino
74431 skanuj0004 (254) 445 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej i i
skanuj0002 (269) 443 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej W 1928 rok
skanuj0008 (186) 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej 449 atomie
29569 skanuj0022 (64) 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej 463 kznyc
85780 skanuj0030 (41) 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej Otrzymano
więcej podobnych podstron