skan0019 (5)

22 Stany skupienia materii
Z połączenia równań (2.2) i (2.4) wynika równanie izochory
P
T
= const, gdy const
lub
P1 P 2
T,
(2.7)
Równanie stanu gazów idealnych
lub dla n moli gazu
pV = RT
pV — nRT
wprowadza stałą gazową R:
|
R |
8,31447 |
1,98720 |
0,082057 |
0,083145 |
|
Jednostki |
J |
cal |
dm3 • atm |
dm3 • bar |
|
K • mol |
K • mol |
K • mol |
K • mol |
Można ją interpretować jako pracę wykonaną podczas obniżenia temperatury jednego mola gazu o 1 K pod stałym ciśnieniem.
Według hipotezy Avogadra 1 mol każdego gazu, zawierający NA = 6,022 • 1023 cząsteczek gazu, zajmuje w 298,15 K pod ciśnieniem standardowym 1 bar objętość 24,790 dm3.
Przykład 2.1. Na powierzchnię wody wrzucono kawałek sodu, a wydzielony wodór gromadzono nad wodą w wykalibrowanej biurecie gazowej. W temperaturze 23,5°C i pod ciśnieniem 745 mm Hg objętość wydzielonego wodom wynosiła 178,5 cm3. Obliczyć masę sodu.
Rozwiązań ie. Zgodnie z równaniem stanu gazów idealnych (2.9)
MpV
gdzie:
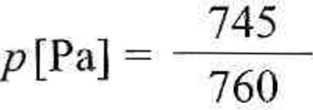
■ 1,01325 -105,
V= 178,5 10"6m3,
M= 22,99-10"3 kg-mol"1,
Wyszukiwarka
Podobne podstrony:
skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równanie
skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równanie
63189 skan0025 (3) 28 Stany skupienia materii(2.22) Analogicznie można wyprowadzić zredukowane równa
29139 skan0023 (6) 26 Stany skupienia materii Rozwiązanie. 1) Obliczanie ciśnienia a) Według równani
skan0031 (3) 34 Stany skupienia materii Przykład 2.7. Zgodnie z równaniem Maxwella-Boltzmanna, ułame
36124 skan0035 (3) 38 Stany skupienia materii Rozwiązanie. Zgodnie z równaniem (2.41) 38 Stany skupi
skan0021 (5) 24 Stany skupienia materii Przykład 2.3. Dla jednoatomowego gazu idealnego=
skan0043 (4) 46 Stany skupienia materii 2c:6. Ułamek cząsteczek gazu dNIN, o prędkościach pomiędzy u
skan0033 (3) 36 Stany skupienia materii średnia droga swobodna równa sięhi ~ gdzie Ar12 oznacza całk
43763 skan0037 (4) 40 Stany skupienia materii b) dla ciekłego CH3OH Par = (M,64 + 3 • 2,74 + 1 • 3,5
więcej podobnych podstron