skan0083

86 Termodynamika chemiczna
ACp(T) = a + bT+cT2 = -\3J2 + 30,05 • 10~3 7- 120,8 • 10~7 72,
a stąd, zgodnie z prawem Kirchhoffa (w postaci dostosowanej do arkusza kalkulacyjnego), mamy
AH°(T) = AH°(T<) - Ti (a + y T, + yr,2) + (a + y y T2]
albo, w zapisie skróconym, oznaczając wyrażenia w nawiasach jako H(7j) i H(7),
AH° (7) = [AH° (Jj) - Ti H (7))] + TH (7) = AH° (0) + TH (7),
gdzie, po podstawieniu wartości liczbowych, wyraz wolny AH° (0) = -280,14 • 103 J • mol-1.
Całkowanie relacji Gibbsa-Helmholtza w podanych granicach prowadzi do wyrażenia
AG°(T)
T
JG°(71)
T\
| |d//°(0) + T{a+%T + i T2) j dT
AH°{ 0) . Tx
+ a ln Ti +
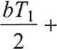
A (7j) - A (7),
^°(°), , rbT cT21
-—--h a ln 7 + —— H--—
gdzie
AH°{0) }rbT cT2 v ' L 7 2 6 J
Podstawiając B = (dG°(71)/7l +^(7^), możemy napisać AG°(T) = [B-A(T)]T, a stąd
AG° (7) = AH° (0) + BT- aT ln 7-4 72 - i 73.
Po podstawieniu wartości liczbowych ^4 (7j) = 865,72 J • K-1 • mol-1, toteż B = 2,73 J • KT1 • mol"1.
Obliczenia, dla ułatwienia, były wykonywane za pomocą arkusza kalkulacyjnego - zob. tab. 3.6.
Tabela 3.6
|
AH°{ 0) |
B |
-a |
-b/2 |
-cl 6 |
|
-280,14 • 103 |
2,730 |
13,72 |
-15,03 • nr3 |
20,13 • 10~7 |
|
7 [K] |
H(T) |
A{T) |
zlG°(7) |
formuła |
|
298,15 |
-9,598 |
865,718 |
-2,573 • 105 |
-2,5730 • 105 |
|
1000 |
-2,722 |
198,376 |
-1,956 • 105 |
-1,9565 ■ 105 |
Wyszukiwarka
Podobne podstrony:
skan0091 (2) 94 Termodynamika chemiczna wynosi AG?9S = żfG$98(NH3) + 4GS98(HC1) - ^G198(NH4C1) = = -
skan0063 (2) 66 Termodynamika chemiczna Przykład 3.11. Obliczyć entalpię parowania toluenu w 25°C, k
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
74354 skan0089 92 Termodynamika chemiczna Tabela
skan0055 58 Termodynamika chemiczna a) Z równania stanu (2.9) obliczamy ciśnienie
skan0057 60 Termodynamika chemiczna zbiorach symbol AH298 oznaczał standardową wartość entalpii twor
skan0059 (2) 62 Termodynamika chemiczna Tak oszacowana wartość AH298 ciekłej gliceryny w niewielkim
skan0061 64 Termodynamika chemiczna zostanie zużyte w całości na ogrzanie produktów tej reakcji do t
skan0079 (2) 82 Termodynamika chemiczna Ciepło reakcji w T= 323,15 K możemy obliczyć z prawa Kirchho
skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i scałkow
więcej podobnych podstron