skan0091 (2)

94 Termodynamika chemiczna
wynosi
AG?9S = żfG$98(NH3) + 4GS98(HC1) - ^G198(NH4C1) = = -16,60 - 95,25 + 203,86 = 92,01 kJ - mor1.
Stała równowagi tej reakcji dana jest wyrażeniem
/?(NH3)/KHC1) / zlG°\
(p°)2a(NH4Cl(5)) expl RT)
exp
92010 8,314 - 298
— I = 7 59 • 10"17 ,15/ ’ '
Aktywność stałego, czystego NH4C1 jest równa jedności. Ze względu na niskie wartości ciśnień reagentów' gazowych ich współczynniki lotności możemy przyjąć za równe 1.
Ponieważ jy(NH3) =/?(HCl) — p, więc
p=p°'lK = 105 - V7,59 -10“17 = 8,71 lO^Pa^ó- 10"9atm). ■
Zależność stałej równowagi od temperatury' określa izobara Van’t Hoffa
(3.85)
/ 0ln/ć\ AH° \ dT )p~ RT2
lub w postaci scałkow'anej (zakładając, że AH reakcji nie zależy od temperatury - słuszne jedynie dla wąskiego przedziału temperatur)

KT\

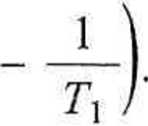
(3.86)
Korzystając ze związku między Kp i Kc dla reakcji przebiegających w fazie gazowej, można wyprowadzić użyteczną relację, będącą odpowiednikiem izoba-ry Van’t Hoffa. Logarytmując wyrażenie (3.80), a następnie różniczkując je względem T, otrzymamy, po uporządkowaniu
d\nKc d\nK Au AH° -AnRT AU° dT ~ dT T RT2 ~ RT2 '
Zależność stałej równowagi Kx od ciśnienia (stała równowagi Kp jest od ciśnienia niezależna) ma postać
9ln Kx\ AV°
~dirl=~i¥- (3-88)
a obserwuje się ją wtedy, gdy w reakcji zmienia się liczba moli gazowych reagentów, gdyż standardowa zmiana objętości reakcji
Wyszukiwarka
Podobne podstrony:
skan0085 88 Termodynamika chemiczna gdzie AG° jest standardową entalpią swobodną reakcji. Warto zwró
skan0063 (2) 66 Termodynamika chemiczna Przykład 3.11. Obliczyć entalpię parowania toluenu w 25°C, k
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
74354 skan0089 92 Termodynamika chemiczna Tabela
skan0053 (2) 56 Termodynamika chemiczna W tab. 3.2 zestawiono wyrażenia, za których pomocą możemy ob
skan0055 58 Termodynamika chemiczna a) Z równania stanu (2.9) obliczamy ciśnienie
skan0059 (2) 62 Termodynamika chemiczna Tak oszacowana wartość AH298 ciekłej gliceryny w niewielkim
skan0061 64 Termodynamika chemiczna zostanie zużyte w całości na ogrzanie produktów tej reakcji do t
skan0079 (2) 82 Termodynamika chemiczna Ciepło reakcji w T= 323,15 K możemy obliczyć z prawa Kirchho
skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i scałkow
więcej podobnych podstron