skan0229

232 Kinetyka chemiczna
Wyznaczyć energię aktywacji oraz czynnik przedeksponencjalny w równaniu Arrheniusa.
Rozwiązanie. Logarytmując równanie (5.45) otrzymujemy postać liniową y = a + bx:
ln/: = In A---- —.
R T
Dane do wykresu (rys. 5.8) przedstawia tab. 5.8 (ze względów praktycznych wykres sporządzamy w funkcji 1000/T).
Tabela 5.8
|
T[ K] |
1000/7 |
k ■ 104 [M-1 • s-1] |
ln A' |
|
273 |
3,663 |
0,237 |
-10,650 |
|
283 |
3,534 |
0,68 |
-9,596 |
|
288 |
3,472 |
1,02 |
-9,191 |
|
298 |
3,356 |
2,64 |
-8,240 |
|
307,5 |
3,252 |
5,9 |
-7,435 |
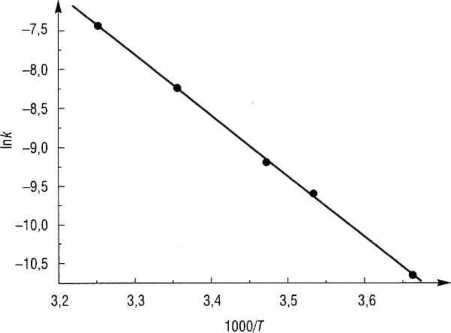
Rys. 5.8
Metodą najmniejszych kwadratów otrzymujemy równanie linii prostej y = (17,94 ± 0,33) - (7,80 ± 0,10)*.
Na tej podstawie obliczona energia aktywacji wynosi EA = 64,9 ± 0,8 kJ ■ mol-1, a czynnik przedeksponencjalny A = 6,16 -107 M_1 • s_1. ■
Standardowe ciepło reakcji w stałej objętości AU® jest równe różnicy energii aktywacji reakcji w prawo i w lewo.
Wyszukiwarka
Podobne podstrony:
51801 skan0211 214 Kinetyka chemiczna [E], M Rys. 5.3. Wyznaczanie czasów połówkowych reakcji dla ró
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
skan0237 240 Kinetyka chemiczna Przykład 5.17. Stałe szybkości reakcji w fazie gazowej 1. &nbs
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
68830 skan0219 222 Kinetyka chemiczna Stąd po scałkowaniu mamy 222 Kinetyka chemiczna CB k„ a a h -
skan0207 210 Kinetyka chemiczna można go uniknąć, obliczając stałe szybkości za pomocą wyrażeń otrzy
skan0223 226 Kinetyka chemiczna wynosi 37 fis. W tej temperaturze gęstość wody wynosi 0,9970 g ■ cm
47714 skan0253 256 Kinetyka chemiczna szybkość powstawania produktu w funkcji [A] i stałych szybkośc
więcej podobnych podstron