27795 skan0142 (2)
Roztwory i równowagi fazowe 145
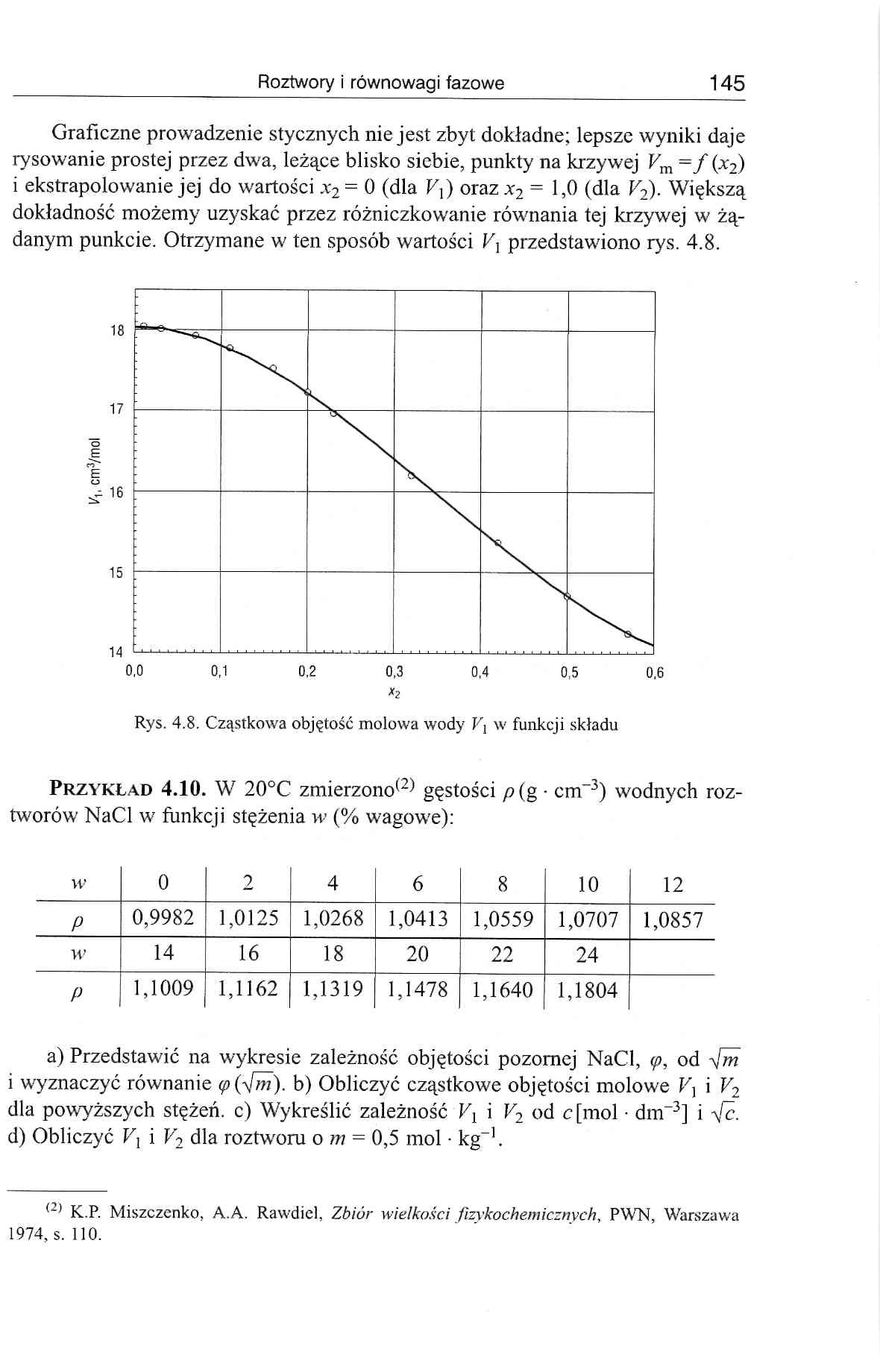
Graficzne prowadzenie stycznych nie jest zbyt dokładne; lepsze wyniki daje rysowanie prostej przez dwa, leżące blisko siebie, punkty na krzywej Vm = f (x2) i ekstrapolowanie jej do wartości x2 = 0 (dla Fj) orazx2 = 1,0 (dla V2). Większą dokładność możemy uzyskać przez różniczkowanie równania tej krzywej w żądanym punkcie. Otrzymane w ten sposób wartości kj przedstawiono rys. 4.8.

0,0 0,1 0,2 0,3 0,4 0,5 0,6
*2
Rys. 4.8. Cząstkowa objętość molowa wody V\ w funkcji składu
Przykład 4.10. W 20°C zmierzono(2) gęstości p(g ■ cm 3) wodnych roztworów NaCl w funkcji stężenia w (% wagowe):
|
W |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
|
p |
0,9982 |
1,0125 |
1,0268 |
1,0413 |
1,0559 |
1,0707 |
1,0857 |
|
w |
14 |
16 |
18 |
20 |
22 |
24 | |
|
p |
1,1009 |
1,1162 |
1,1319 |
1,1478 |
1,1640 |
1,1804 |
a) Przedstawić na wykresie zależność objętości pozornej NaCl, <p, od a/w i wyznaczyć równanie (p{fm). b) Obliczyć cząstkowe objętości molowe Fj i V2 dla powyższych stężeń, c) Wykreślić zależność V1 i V2 od c[mol • dm-3] i Vć-d) Obliczyć Fj i V2 dla roztwroru o m = 0,5 mol • kg-1.
<2) K.P. Miszczcnko, A.A. Rawdicl, Zbiór wielkości fizykochemicznych, PWN, Warszawa 1974, s. 110.
Wyszukiwarka
Podobne podstrony:
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0158 (2) Roztwory i równowagi fazowe 161 Przy wyznaczaniu entalpii cząstkowych metodą graficzną
28708 skan0156 Roztwory i równowagi fazowe 159 Podobnie jak poprzednio, wartość poehodnej możemy wyz
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0170 (2) Roztwory i równowagi fazowe 173 mamy MC* AH° = AH°opni + (T- 7t więc otrzymane wyrażeni
skan0178 Roztwory i równowagi fazowe 181 v - 0 x-0 8-0 10-0=*y = 0,8 • *. Linia Sb przechodzi przez
skan0123 4. Roztwory i równowagi fazowe Roztworem nazywamy homogeniczną mieszaninę dwu lub więcej su
skan0134 Roztwory i równowagi fazowe 137 Rozwiązanie. Entalpia topnienia w zadaniu dotyczy 1 grama b
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
więcej podobnych podstron