62185 skan0131

134 Roztwory i równowagi fazowe
Zależność między aktywnością rozpuszczalnika aj a aktywnością substancji rozpuszczonej a2 określa równanie Gibbsa-Duhema
X\d\na\ + x2d\na2 - 0, (4.15)
zgodnie z którym aktywności składników nie mogą zmieniać się w sposób niezależny. Jeżeli znana jest aktywność jednego z nich jako funkcja składu oraz aktywność drugiego dla jakiegoś jednego stężenia, to całkując to równanie można obliczyć aktywność drugiego składnika dla innych stężeń.
Przykład 4.5. Badając w 50°C prężność i skład par1 nad mieszaniną 1,4-^dioksanu (1) i chloroformu (2) uzyskano poniższe wartości aktywności 1,4-dioksanu:
|
*1 |
0,8 |
0,7374 |
0,6385 |
0,525 |
0,4445 |
0,3282 |
0,122 |
|
“1 |
0,795 |
0,727 |
0,603 |
0,462 |
0,358 |
0,230 |
0,054 |
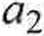
Obliczyć aktywność chloroformu a2 w mieszaninie o x] = 0,122, wiedząc, że w mieszaninie o X\ = 0,8 wynosi 0,106.
Rozwiązanie. Przekształcając równanie Gibbsa-Duhema (4.15): 'Lxidln at = = 0, do postaci
x2 d ln a2 = - Xj d ln a \,
otrzymujemy równanie całkowe
b B x
<71ncb=- —~ d\na\,
J J To
A A
gdzie A oznacza = 0,8 (odpowiada mu a2 - 0,106) natomiast B oznacza = = 0,122. Rozwiązanie tego równania ma postać
B
ln (a2)B = ln (a2)A -J —L dlna^
A *2
Na podstawie danych zawartych w tab. 4.3 wykreślamy funkcję podcałkową x\lx2 w zależności od ln ax (rys. 4.3). Znaleziona metodą trapezów (zob. przykład 3.16, s. 76), wartość całki w tych granicach wynosi ZR, = -2,0972. Po podstawieniu tej liczby do równania na aktywność otrzymamy ln(a2)/; = ln0,106 -- (-2,0972) = -0,1471; (a2)B = 0,863.
Porównując ją z wyznaczoną doświadczalnie aktywnością chloroformu (a2 = = 0,858), w mieszaninie o tym składzie, możemy uznać zgodność za bardzo dobrą. Jest to zarazem sprawdzian poprawności zarówno pomiarów, jak i obliczeń wszystkich wartości a](x1).
H. Buchowski, W. Ufnalski, Roztwory, WNT, Warszawa 1995, s. 69.
Wyszukiwarka
Podobne podstrony:
skan0157 (2) 160 Roztwory i równowagi fazowe Zależność wraz z równaniem <£>,
34759 skan0145 (2) 148 Roztwory i równowagi fazowe Rys. 4.9. Zależność objętości pozornej NaCl w roz
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
skan0155 158 Roztwory i równowagi fazowe Po podstawieniu odpowiednich wartości z tab. 4.9 dostaniemy
skan0167 170 Roztwory i równowagi fazowe Rys. 4.20. Równowaga w układzie dwuskładnikowym, ciało stał
skan0171 (2) 174 Roztwory i równowagi fazowe Przykład 4.16. W tab. 4.12 zestawiono dla ciśnienia 760
skan0195 198 Roztwory i równowagi fazowe Temperatury wrzenia benzenu i toluenu pod ciśnieniem 400 mm
12851 skan0127 130 Roztwory i równowagi fazowe wego w wodzie c i ksylenie c" wynosiły odpowiedn
skan0125 128 Roztwory i równowagi fazowe Zatem 0,343 0,343 + 5,11 0,0629; x} = 1 -x2 = 0,937. c) Stę
skan0133 136 Roztwory i równowagi fazowe Temperatura krzepnięcia roztworu Tk, zawierającego nielotną
skan0135 138 Roztwory i równowagi fazowe Rozwiązanie. Do obliczeń y2 wykorzystamy wzór (4.20) 0- 1 m
więcej podobnych podstron