Zad 21
Entropia układu zamkniętego i izolowanego nie może maleć podczas dowolnej przemiany i wzrasta przy przemianach nieodwracalnych. W praktyce stosuje się najczęściej przyrosty entropii lub względne wartości entropii ponad stan przyjęty umownie za zerowy.
Przyrost entropii dla substancji stałych i ciekłych o stałym cieple właściwym
cp>cv = c = const można zapisać w postaci
![]()
(17
Ze wzoru na entropię ciepło przemiany jest równe:
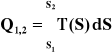
(18)
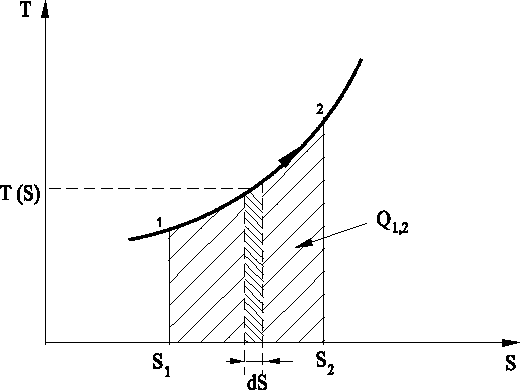
Rys. 3. Interpretacja ciepła przemiany na wykresie T-S
Ciepło przemiany jest dodatnie, gdy entropia rośnie, a ujemne gdy
entropia maleje.
Ponieważ dla gazów i par cp > cv, na wykresie o współrzędnych T-S izobara
przebiega łagodniej od izochory. W przemianach odwracalnych
pole to jest miarą ciepła wymienianego z otoczeniem, natomiast dla przemian
nieodwracalnych z tarciem przedstawia sumę ciepła wymienianego z
otoczeniem oraz ciepła Qf doprowadzonego nieodwracalnie.
Przyrost entropii układu można rozdzielić na część spowodowaną wymianą
ciepła z otoczeniem
![]()
gdzie: dQ - ciepło wymienione z otoczeniem
oraz zawsze dodatnie wytworzenie entropii wewnątrz rozpatrywanej części
układu spowodowane zjawiskami nieodwracalnymi np. praca tarcia
zostaje zamieniona na ciepło tarcia (dQf = dLf).
Entropia układu adiabatycznego na skutek przemian nieodwracalnych wzrasta
a w przypadku przemian odwracalnych nie zmienia się.
Wyszukiwarka
Podobne podstrony:
zad. I.21, MiBM WIP PW, inżynierskie, 4 semestr, TERTE, I kolokwium
javaczeni, 08.02.21 Egzamin Progr, Zad
IChiP zad 1,4,6,14,19,21,24
21.02.2014.Zad.MaturaDoPowtórki, studia I.II
Zaliczenie dzienne statystyka 21 STYCZNIA 2003 teoria, ZAD
Zad 2 21
Krzysztof Kleszcz Zad+21
IChiP zad 1,4,6,14,19,21,24
W 21 Alkohole
wm 2011 zad 2
21 02 2014 Wykład 1 Sala
21 Fundamnety przyklady z praktyki
BO I WYKLAD 01 3 2011 02 21
w 1 komunikacja 21 11 09 nst
Instrukcja do zad proj 13 Uklad sterowania schodow ruchom
więcej podobnych podstron