23118 skanowanie0005z

I Wzrost turnpn I Mitury zwiększa I szybkość | reakcji.
W podwyższonej temperaturze cynk reaguje t kwasem solnym /ulicznic energiczniej niż w temperaturze pokojowej, ponieważ wzrost tempo* ratury przyspiesza przebieg reakcji chemicznych. Aby zatem zwiększyć szybkość danej reakcji, najczęściej ogrzewamy układ reakcyjny - robiliśmy tak na przykład podczas nitrowania toluenu czy estryfikacji etanolu kwasem octowym. Taka metoda zmiany szybkości reakcji ma jednak pewne ograniczenia - nie można jej stosować w wypadku, gdy reagenty nie są odporne na działanie wysokiej temperatury.
|
;d) |
: b). |
Doświadczenie
Badanie wpływu stężenia substratów i rozdrobnienia substancji na szybkość reakcji chemicznej

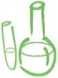
Ryc. 1.2. Szybkość reakcji zależy od stopnia rozdrobnienia stałych substratów: a) kawałki cynku kontaktują się z kwasem solnym niewielką powierzchnią, dlatego reagują powoli; b) wiórki cyn-' ku mają znacznie większą powierzchnię kontaktu z kwasem, dlatego reakcja przebiega szybko.
Przygotuj 0,1-molowy i 1-molowy kwas solny oraz cynk w postaci granulek i wiórków lub pyłu.
1) W dwóch zlewkach umieść identyczne granulki cynku. Do jednej ze zlewek dodaj 2 cm3 0,1-molo-wego kwasu solnego i jednocześnie do drugiej 2 cm31-molowego kwasu solnego. Porównaj szybkość wydzielania się pęcherzyków gazu w obu zlewkach.
2) W jednej zlewce umieść kawałek cynku, natomiast w drugiej - wiórki I lub pył cynkowy. Następnie do obu zlewek dodaj 2 cm3 0,1-molowego I kwasu solnego. Porównaj szybkość wydzielania się pęcherzyków gazu I w obu zlewkach (ryc. .1.2).
Wzrost stężenia substratów lub ich rozdrobnienie zwiększa szybkość reakcji.
Wzrost stężenia substratów również powoduje zwiększenie szybkości I reakcji chemicznej. W wypadku użycia do reakcji substancji stałych, ta- I kich jak cynk, nie możemy jednak zwiększyć ich stężenia. Zamiast tego 1 możemy bardziej je rozdrobnić. Prowadzi to do zwiększenia powierżch-1 ni, którą stały reagent kontaktuje się z pozostałymi substratami, a tym 1 samym do przyspieszenia przebiegu reakcji.
Niekiedy można uzyskać wzrost szybkości reakcji, odpowiednio dobie- ] rając rozpuszczalnik, w którym zachodzi proces: rozpuszczalniki polarne I ułatwiają reakcje pomiędzy związkami polarnymi, natomiast rozpusz- 1 czalniki niepolarne należy stosować do zwiększania szybkości reakcji I związków niepolarnych. Wytłumaczenie tego faktu jest proste - odpo- I wiednio dobrany rozpuszczalnik pozwala na dokładne wymieszanie się I cząsteczek substratów, ułatwiając kontakt między nimi.
Szybkością niektórych reakcji można również Minować, dodając do mieszaniny reakcyjnej katalizator lub Inhlhlloi Knlttll/alomn nazywamy NiihNlitnuję zwlęU/ujijni upybkolW renkcjl, Inhibitorom NubNlnncję nhni>(iji)ci) szybkość rOAKOjli /mńwno katalizator, Jllk i Inhibitor nic nlo-finji) zużyci u podoznu reakcji - po jej zakończeniu pozostają w takiej samej Ilości i formie chemicznej, jak przed rozpoczęciem procesu. Nic oznacza to jednak, że nie biorą udziału w reakcji chemicznej - katalizatory i inhibitory wchodzą w reakcję z substratami, ale potem ulegają odtworzeniu (dokładny mechanizm działania tych związków omówimy w następnym podrozdziale).
Katalizatory i inhibitory cechują się zazwyczaj wysoką specyficznością działanie każdego z nich ogranicza się najwyżej do kilku różnych reakcji. Jeśli zatem tlenek wanadu(V) jest katalizatorem procesu utleniania tlenku siarki(IV) do tlenku siarki(VI), to nie oznacza, że będzie on również kutalizował reakcje utleniania innych tlenków.
Katalizatory i inhibitory dzielą się na homogeniczne - występujące w tej samej fazie co substraty, oraz heterogeniczne - stanowiące odrębną fazę. Do katalizatorów homogenicznych zaliczamy na przykład kwas Nlarkowy(VI) używany w reakcji estryfikacji kwasu octowego etanolem, ponieważ stanowi on składnik tego samego roztworu, co kwas i alkohol. Przy kładem katalizatora heterogenicznego jest platyna, ciało stałe, wykorzystywane w reakcji uwodornienia etenu, czyli reakcji przebiegającej między gazami. Stałe katalizatory, ułatwiające reakcje między gazami, są nazywane kontaktami.
Doświadczenie
lindanie wpływu katalizatora na szybkość reakcji
1 )o małej zlewki nalej 5 cm3 wody utlenionej, czyli 3% roztworu nad-I linku wodoru. Obserwuj roztwór przez kilka minut. Następnie dodaj do roztworu szczyptę tlenku manganu(IV). Zaobserwuj przebieg reakcji, a po jej zakończeniu ustal, czy tlenek manganu(IV) nadal pozostaje w zlewce, czy też uległ zużyciu.
Tlenek manganu(IV) katalizuje rozkład nadtlenku wodoru. Po dodaniu tego odczynnika do roztworu H202 następuje intensywne wydzielanie się pęcherzyków tlenu, zgodnie z równaniem:
MnO,
2H202 — 2 H20 + 02t
I 'rnccs rozkładu bez katalizatora przebiega na tyle powoli, że powstawanie pęcherzyków tlenu jest prawie niewidoczne.
Halą katalizatorów reakcji przebiegających w organizmach żywych pełnią specjalne białka nazywane enzymami. W organizmie człowieka występuje około 10 tysięcy różnych enzymów.
Katalizatory dzlfi-limy na homogn-niczne I heterogeniczne. Katalizatory homogenlozne występują w te) same) fazie oo substraty, holtiio genlczno różnią się fazą od substratów


Wyszukiwarka
Podobne podstrony:
skanowanie0005z I Wzrost turnpn I Mitury zwiększa I szybkość
skanowanie0005z I Wzrost turnpn I Mitury zwiększa I szybkość
SDC10488 (2) © •Wpływ temperatury na aktywność enzymów Wzrost temperatury zwiększa szybkość reakcji
jak również zmniejszenie wydajności procesu, aby więc zwiększyć szybkość reakcji głównych, należy
LastScan1 (4) ENZYMY Enzymy Enzymy przekształcają różne formy energii, zwiększają szybkość reakcji
DSC00304 3 Dalsze zwiększanie stężenia substratu nie zwiększa szybkości reakcji. Enzym nie może
ENZYMY • są katalizatorami, które zwiększają szybkość reakcji chemicznej •
456 [1024x768] 466 KINETYKA CHEMICZNA Z ma wymiar szybkości reakcji; wyraża liczbę cząsteczek reaguj
WYKŁAD 2 enzymy cz 1 (26) WPŁYW TEMPERATURY NA SZYBKOSC REAKCJI ENZYMATYCZNE A Temperatura ma wpł
CCF20081011�015 Ćwiczenie 2Enzymy - Czynniki kinetyczne wpływające na szybkość reakcji enzymatycznej
DSCN4111 Zależność szybkości reakcji od temperatury Równanie Arrheniusa _j przecie* -4nA In k = I
54782 skanowanie0005 (158) 6. Stale i stopy żelaza o szczególnych własnościach w podwyższonej temper
więcej podobnych podstron