36459 skan0234

Kinetyka chemiczna 23 7
Porównać wartość współczynnika przedeksponencjalnego w tym równaniu z obliczonym według teorii zderzeń w 600 K. Średnice zderzeniowe w tej temperaturze wynoszą 2,62 A dla H2 i 6,35 A dla I2.
Rozwiązanie. Zgodnie z teorią aktywnych zderzeń stałą szybkości tej reakcji opisuje równanie
k2 = P • 103 • NAnalBwexp -|^j = zttC0retexp
Tak więc współczynnik przedeksponencjalny obliczymy z wyrażenia
AtC0[et = P • 103 ■ NakgIbw,
gdzie
^ab —
^h2 + ^i2 2
2,62 + 6,35
•10
-10
4,48- 10-10 m.
Względną prędkość średnią w obliczymy zgodnie ze wzorem
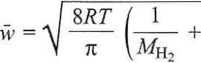
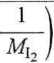
+
-103 = 2520,1 m-s”1.
8-8,314-600
3,1416
1
2,016 253,8
Ostatecznie, teoretyczna wartość współczynnika przedeksponencjalnego wynosi -'Aeoret = P • 103 • 6,02 • 1023 • 3,1416 • (4,48 • 10"10)2 ■ 2520,1 =
= P • 3,05 • 1011 [M-1 -s"1].
Porównując ją z wielkością zmierzoną doświadczalnie (/tdośw = 1,60 • 1011), możemy obliczyć czynnik steryczny P = 0,52. Oznacza to, że tylko co drugie zderzenie cząsteczek H2 i I2 prowadzi do powstania cząsteczki HI. ■
W teorii absolutnych szybkości reakcji (teoria stanu przejściowego)
zakłada się, że substraty tworzą, będący z nimi w równowadze, aktywny kompleks, który następnie ulega rozpadowi na produkty:
A + B ^ (AB)# \ produkty. (5.54)
Szybkość reakcji powstawania produktów jest iloczynem częstotliwości rozpadu kompleksu vk i jego stężenia c#:
v = kcAcB = vkcir =
k»T
h
(5.55)
Wyszukiwarka
Podobne podstrony:
36100 skan0214 Kinetyka chemiczna 217 W chwili t spełnione są równocześnie dwa równania: 1) Pno2(0 =
28429 skan0216 Kinetyka chemiczna 219 gdzie x jest przyrostem [B], Rozwiązaniem tego równania jest w
CCF20110310�006 i(t) =I (r/T) ° cT/t Ul + (r/T) °(2.1) Wartości współczynników występujących w tym r
496 [1024x768] 506 KINETYKA CHEMICZNA ko—ffcw Porównać pojęcia rzędowości, cząstcczkowości i współcz
skan0226 Kinetyka chemiczna 229 W przypadku bardziej ogólnym, dla wyższych wartości współrzędnej che
skan0232 Kinetyka chemiczna 235 Z różnicy obliczonych w ten sposób wartości energii aktywacji EA(i)
skan0218 Kinetyka chemiczna 221 w którym po etapie (1), z szybko ustalającą się równowagą, następuje
skan0228 Kinetyka chemiczna 231 W przybliżeniu stanu stacjonarnego mamy = ki[A]" - *2[L][A] + a
skan0200 (2) Kinetyka chemiczna 203 Szybkość reakcji A B zgodnie z równaniem (5.1) wyraża się
więcej podobnych podstron