28429 skan0216

Kinetyka chemiczna 219
gdzie x jest przyrostem [B], Rozwiązaniem tego równania jest wyrażenie
Kinetyka chemiczna 219
ln
kaa-khh
kaa - kbb - (ka + kh)x
- (ka + kh) t.
(5.22)
Łatwo znaleźć związek między stałą równowagi (Kc) a stałymi szybkości (A'„ kj,).
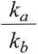
(5.23)
gdzie c® jest stężeniem standardowym, 1 mol • dm-3 (1 M).
Należy zauważyć, że oznaczenia Xvj oraz K( dotyczą wyłącznie reakcji elementarnej dla etapu zwanego limitującym albo determinującym, czyli etapu decydującego o kinetyce procesu, a nie sumarycznego równania stechiometrycz-nego reakcji.
Przykład 5.8. Wyprowadzić wyrażenie na stałą szybkości k2 reakcji odwracalnej (obie reakcje są II rzędu)
k2
A + B 5=t C.
*-2
Przyjąć, że [A]0 = [B]0 = a oraz, że w chwili t = 0 stężenie produktu jest równe zeru (x = 0).
Rozwiązanie. Zapiszmy pod schematem reakcji stężenia początkowe reagentów (/ = 0) i w chwili f.
k?
|
A + |
B |
** C k_2 |
|
a |
a |
0 |
|
a —x |
a — x |
X |
Szybkość tej reakcji wyrazimy równaniem różniczkowym
dx
~dł
k2{a-x)2 - k_2x2.
W stanie równowagi dx/dt = 0, a zatem
.. \2
k-> — k_o
(a-xT)2 ’
podobnie k_2 = k2
{a - xr)-
oraz
k2a2 = lk2axr - (k2 - k_2)x~.
Wyszukiwarka
Podobne podstrony:
while w do I gdzie w jest wyrażeniem typu boolowskiego a I jest instrukcją. Przykład. while x<y d
Image0071 BMP Rozwiązaniem tego równaniu jest niezależna od czasu funkcja l ---a;+b, gdzie a oraz b
(5,5)r,TT“«M +“KO = -*„/« ». de{l) e(0),e(0) Rozwiązaniem tego równania jest trajektoria stanu
20739 img037 (6) □ Rozwiązanie tego równania ma postać: D Dn gdzie: N = N0 • e N -ilość komórek zdol
= 0 300-(XL -10) (R + 30)2 +(XL -10)2 Rozwiązaniem tego równania jest Xi =10 fi Stąd wartość skutecz
skan0246 Kinetyka chemiczna 249 k = v CACB ~ K*(c®fv> h y }A 7 B (5.78) gd
skan0251 254 Kinetyka chemiczna a — «<*, w którym a0 jest kątem skręcenia płaszczyzny polaryzacji
58556 skan0238 Kinetyka chemiczna 241 ASoU możemy obliczyć za pomocą wyrażenia (5.62) lub (5.64). To
skan0244 Kinetyka chemiczna 247 v = k&A0 B, gdzie stopień obsadzenia powierzchni przez każdy z s
skan0218 Kinetyka chemiczna 221 w którym po etapie (1), z szybko ustalającą się równowagą, następuje
skan0228 Kinetyka chemiczna 231 W przybliżeniu stanu stacjonarnego mamy = ki[A]" - *2[L][A] + a
więcej podobnych podstron