66440 skanuj0034 (31)

475
14.5. Związki przeciwbakteryjne zaburzające syntezę ściany komórkowej
nie soli wewnątrz komórki jest dużo większe niż na zewnątrz, dlatego też woda wnika do komórki przez uszkodzoną ścianę, komórka puchnie i w końcu następuje jej liza (pęka). Enzymem odpowiedzialnym za sieciowanie ściany komórkowej jest transpeptydaza.
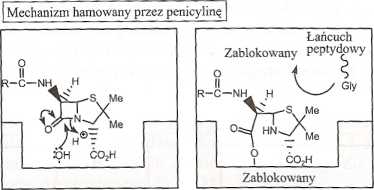
Zasugerowano, że penicylina przyjmuje konformację podobną do konformacji, jaką w stanie przejściowym ma fragment D-Ala-D-Ala, który jest częścią łańcucha peptydowego biorącego udział w sieciowaniu (rys. 14.63). Ponieważ jest to centrum reakcji dla transpeptydazy, wydaje się całkiem prawdopodobna teoria, że enzym myli cząsteczkę penicyliny z resztą D-Ala-D-Ala i przyjmuje penicylinę do swojego miejsca aktywnego. Ponieważ w tym aktywnym miejscu jest teraz penicylina, więc na niej będzie przebiegała reakcja enzymatyczna.

Normalny mechanizm
Łańcuch
peptydowy
c ^
-—D-A!a-D-Ala-CO,H / sto
Transpeptydaza
R-C-NhL H
OzJ hi!k
Zablokowany nieodwracalnie
Rysunek 14.63. Mechanizm sieciowania pod wpływem transpeptydazy
Łańcuch
Łańcuch peptydowy peptydowy c
i
D-Ala
I—-* € O ' H
'Gly
Łańcuch Łańcuch peptydowy peptydowy
-D-A!a—Gly
Zablokowany
H,0
Podczas normalnej reakcji enzymatycznej (rys. 14.63) wiązanie amidowe między dwiema resztami alaniny łańcucha peptydowego pęka. Końcowa cząsteczka alaniny opuszcza miejsce aktywne, pozostawiając łańcuch peptydowy związany z miejscem aktywnym. Teraz końcowa cząsteczka glicyny pentagli-cylowego łańcucha może wejść do miejsca aktywnego i utworzyć wiązanie pep-tydowe z alaniną, usuwając ją tym samym z tego miejsca.
Enzym może atakować i otwierać pierścień p-laktamowy penicyliny w ten sam sposób, w jaki czynił to z wiązaniem amidowym. Penicylina jednak jest
Wyszukiwarka
Podobne podstrony:
skanuj0026 (54) 467 14.5. Związki przeciwbakteryjne zaburzające syntezę ściany komórkowej Wyizolowan
12951 skanuj0032 (33) 473 14.5. Związki przeciwbakteryjne zaburzające syntezę ściany komórkowej 14.5
skanuj0006 (213) 14.5. Związki przeciwbakteryjne zaburzające syntezę ściany komórkowej 447 realizacj
skanuj0018 (87) 14.5. Związki przeciwbakteryjne zaburzające syntezę ściany komórkowej 459 cielem
86195 skanuj0036 (33) 14.5. Związki przeciwbakteryjne zaburzające syntezę ściany komórkowej 477 ^*5*
skanuj0020 (74) 461 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej ryny mogą s
skanuj0024 (57) 465 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej •
skanuj0028 (48) 469 14.5. Związki przedwbakteryjne zaburzające syntezę ściany komórkowej Lek ten jes
więcej podobnych podstron