skanuj0028 (Kopiowanie)

steczki są elektrycznie obojętne (nitrogliceryna, azotan pentaerytrytolu, tolbutamid, paracetamol itp.) Większość substancji leczniczych stanowi jednak słabe kwasy i zasady, które dysocjują na jony w zależności od ich pKa, jak i od kwasowości (pH) środowiska.
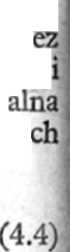
Wpływ pH na proces dyfuzji słabych elektrolitów omawia tzw. kwasowo--zasadowa teoria podziału (pH partition theory) opracowana prz Brodiego, Hogbena i wsp. Zgodnie z tą teorią, szybkość dyfuzji substancj leczniczej o charakterze słabego kwasu lub słabej zasady jest proporcjon do stężenia nie zdysccjowanej formy substancji obecnej po obu strona błony biologicznej:
dC hC
— /vv-»nic zdys.
Stężenie nie zdysocjowanej części kwasu (zasady) jest równe iloczynowi całkowitego stężenia (C) przez ułamek części nie zdysocjowanej (/nie zdys.):
Cnie zdy«. — /nie zdys. ' C
Tym samym można napisać:
k */nic zdys. ’ C
(4.5)
dC
dr
(4.6)
Ułamek nie zdysocjowanej części kwasu o wykładniku stałej dysocjacji pKa, jaki jest obecny w środowisku o danym pH określa równanie:
/
nie zdys.
1
14-10PH-PK*
Dla zasad ułamek ten przedstawia się następująco:
1
(4.7)
nie zdys. —
i+ioi>K»-pH
(4.8)
Rozważmy proces dyfuzji substancji leczniczej, będącej słabym kwasem o wykładniku stałej dysocjacji pKa, z osocza o pH = pH0 do środowiska
|
Dla tej substancji stężenie części (Cnie zdys. (0)) i w środowisku o pH = |
nie zdysocjowanej obecnej w osoczu = pH, (Cniezdys. (o) określają równania: | |
|
/'■» |
C(o> . |
(4.9) |
|
'-'nie zdys. (0) — |
1 Ij. iopH«~pK* | |
|
oraz | ||
|
z-* |
C(o |
(4.10) |
|
'-'nie zdys. (0 | ||
54 Zarys biofarmacji
\
|
Substancja lecznicza zdysocjowana i |
y/V7777; SI |
Substancja lecznicza zdysocjowana |
|
fM |
• | |
|
< Substancja lecznicza nie zdysocjowana |
ifl |
r Substancja lecznicza nie zdysocjowana |
.Osocze o pH ~ pH0 Środowisko opH = pHi
Ryc. 4.4. Transport bierny kwasów i zasad (objaśnienia w tekście)
Ponieważ w stanie równowagi, jaki się ustala w procesie dyfuzji, szyb- • kości przechodzenia substancji leczniczej w obie strony przez błonę biologiczną są jednakowe, wobec tego zakładając, że odpowiednie współczynniki proporcjonalności dla przechodzenia nie zdysocjowanej cząsteczki kwasu z osocza do innego środowiska są jednakowe, można napisać:
fio == fi°)_ (a i n
1 + 10PH<-PK. l-fl()PH*-pK» ^ J
Stąd, po prostych przekształceniach otrzymuje się następujący wzór na współczynnik podziału (R,-«»):
Rim - C7oy
1 + 10pHł-pKa l _|_ 10pH,rpKa
(4.12)
Rozumując analogicznie otrzymamy, że dla substancji leczniczej o charakterze słabej zasady, współczynnik /?,-«» będzie określony równaniem:
(4.13)
C(l) 1 -f lOpKa“pHł
,(0) " C(o> 1 + 10pKa~pH«
Z obu ostatnich równań wynika, że stosunek stężeń substancji leczniczej będącej słabym kwasem lub słabą zasadą, po obu stronach błony oddzielającej środowiska o różnym pH, jest odwrotnie proporcjonalny do ułamka nie zdysocjowanej formy substancji, znajdującej się po obu stronach błony.
Równania te mają duże znaczenie praktyczne, znając bowiem pKa substancji' leczniczej i pH środowiska, po obu stronach błony, można obliczyć, czy i w jakim stopniu przechodzi ona przez tę błonę. W ten sposób można wykazać, że środowisko kwaśne sprzyja wchłanianiu substancji o charakterze słabych kwasów, natomiast środowisko zasadowe sprzyja wchłanianiu substancji o charakterze słabych zasad, np. po ustaleniu się równowagi w procesie wchłaniania kwasu salicylowego (pKa = 3) z żołądka (pH 1) do krwi (pH 7,4), stosunek stężenia kwasu salicylowego w żołądku
Wchłanianie substancji leczniczej 55
Wyszukiwarka
Podobne podstrony:
skanuj0117 (Kopiowanie) o ile są nierozpuszczalne, kontrolują szybkość uwalniania substancji 1 nicze
fizjo cw 4 3 3 X•Prawo U9 płyny ustrojowe wszystkich przestrzeni wodnych są elektrycznii obojęt
skanuj0076 (Kopiowanie) licie denkiem biernie wchłania się woda, tłuszcze, niektóre elektrolity, cuk
skanuj0070 (Kopiowanie) w którym stałe B i A są określone równaniami: FD (9.8) FD . _ TTe (9.9)
skanuj0024 (Kopiowanie) Skład chemiczny komórki. Najważniejszymi składnikami komórki są woda, sole m
skanuj0050 (Kopiowanie) się w cewkach przez transport czynny, a więc proces wymagający energii i uży
skanuj0082 (Kopiowanie) Zjawisko to stwierdzono dla wielu substancji leczniczych, jakkolwiek są równ
skanuj0090 (Kopiowanie) Szczególnie częstym schorzeniem są guzy krwawnicze wywołane po szerzeniem ży
środkiem ciężkości jądra, w którym skupione są ładunki dodatnie. Atom taki jest elektrycznie obojętn
skanuj0008 (Kopiowanie) wego do centralnego, przy czym w obydwu przypadkach są to stałe reakcji I rz
więcej podobnych podstron