293 [1024x768]

302
ROZTWORY I RÓWNOWAGI FAZOWE
Destylacja
Przeanalizujmy dokładniej prosty diagram wrzenia (rys. 4.12) dla układu doskonałego lub dla układu wykazującego niewielkie odstępstwo od doskonałości. Weźmy roztwór o początkowym składzie (a) i poddajmy ogrzewaniu. Po osiągnięciu temperatury T, ciecz zaczyna wrzeć, gdyż osiągnęliśmy krzywą równowagi ciecz—para. Skład pary (b) jest bogatszy w składnik A; może być łatwo odczytany na krzywej składu pary. Taki jednorazowy krok jest mało
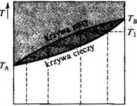
dc ba
100* A 100*1}
Rys. 4.12. Prosty diagram procesu destylacji frakcyjnej
efektywny, jeżeli chodzi o wzbogacenie jednego ze składników, chyba że różnią się one bardzo znacznie temperaturą wrzenia. W praktyce stosuje się proces destylacji frakcyjnej, w której jednostkowy etap wzbogacenia przedstawiony poprzednio jest powtórzony wielokrotnie poprzez skroplenie wydzielającej się pary, kolejno odparowanie nowego roztworu, znów skroplenie i odparowanie itd. Procedura taka odpowiada przejściom schodkowym pokazanym na rys. 4.12.
Po przeprowadzeniu 3 kolejnych procesów odparowania i kondensacji pokazanych na rysunku uzyskujemy destylat o składzie d. Schodkowy proces destylacji odbywa się w praktyce automatycznie w kolumnach destylacyjnych, których budowę przedstawiono schematycznie na przykładzie urządzenia laboratoryjnego i przemysłowego (rys. 4.13, 4.14). W kolumnie przemysłowej możemy wyróżnić poszczególne półki, na których odbywają się kolejne etapy procesu schodkowego. Para wydzielająca się podczas wrzenia destylowanej cieczy przechodzi do pierwszej półki, tu się skrapla, powodując odparowywanie bardziej lotnej cieczy, bogatszej w składnik lotnicjszy. Para wydzielająca się z pierwszej półki kondensuje się na drugiej półce, skąd ulatnia się para jeszcze bogatsza w składnik lotnicjszy itd. Wzbogacanie na każdej półce jest oczywiście mniejsze od wzbogacenia teoretycznego równoważnego jednemu schodkowi na krzywej z rys. 4.12. Gdy wzbogacenie jest równoważne jednemu
Wyszukiwarka
Podobne podstrony:
302 [1024x768] 310 ROZTWORY I RÓWNOWAGI FAZOWE12• Obniżenie temp. krzepnięcia dla 0,1 m roztworu kwa
271 [1024x768] 280 ROZTWORY I RÓWNOWAGI FAZOWE jeżeli nie takie same, to w każdym razie bardzo podob
275 [1024x768] 284 ROZTWORY I RÓWNOWAGI FAZOWE czystego rozpuszczalnika i roztworu. Punkt krzepnięci
277 [1024x768] 286 ROZTWORY I RÓWNOWAGI FAZOWE — Iń jc, =A//. f dr r !rł A Hw / 1 r r,a//* / r-r,
281 [1024x768] 290 ROZTWORY J RÓWNOWAGI FAZOWE W tym przypadku nie ma znaczenia, czy para nad roztwo
283 [1024x768] 292 ROZTWORY I RÓWNOWAGI FAZOWE (4.37) gdzie //(r„c„, — ciśnienie osmotyczne rzeczywi
285 [1024x768] 294 ROZTWORY 1 RÓWNOWAGI FAZOWE gdzie: L, — ciepło sublimacji, a Lm —ciepło parowania
295 [1024x768] 304 ROZTWORY I RÓWNOWAGI FAZOWE mniej lub bardziej trwałych związków pomiędzy składni
297 [1024x768] 306 ROZTWORY I RÓWNOWAGI FAZOWE przeciwległego do wierzchołka odpowiadającego czystem
300 [1024x768] 308 ROZTWORY I RÓWNOWAGI FAZOWE podwójnych. Obszar H20aeb obejmuje nienasycone roztwo
263 [1024x768] 272 ROZTWORY I RÓWNOWAGI FAZOWE Ścisła definicja fazy jest więc następująca: Fazą naz
265 [1024x768] 274 ROZTWORY 1 RÓWNOWAGI FAZOWE Ponieważ dG = Vdp — SdTyoydp-Si^dT - y^dp-S^dT (4.6)
267 [1024x768] 276 ROZTWORY 1 RÓWNOWAGI FAZOWE px jest tu szukanym ciśnieniem pary w temp. 33°C, nat
269 [1024x768] 278 ROZTWORY I RÓWNOWAGI FAZOWE wyżej temp. 374°C, tj. powyżej temperatury krytycznej
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
279 [1024x768] ROZTWORY I RÓWNOWAGI FAZOWE niż nad roztworem, wobec tego zachodzić będzie proces sta
więcej podobnych podstron