277 [1024x768]

286
ROZTWORY I RÓWNOWAGI FAZOWE
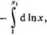
— Iń jc, =
A Hw / 1
r \ r,
(4.29)
Jeżeli podwyższenie temperatury wrzenia jest niewielkie, iloczyn T• r, można zastąpić przez T\; xx możemy z kolei zastąpić przez l-*2, a dla bardzo małych wartości x2 wyrażenie -ln(l-x2) równe jest wprost x2. Stąd
A//.
RT\
atw
a więc otrzymujemy równanie identyczne z równaniem (4.22).
Podobnie prowadzone rozważania dla procesu krzepnięcia prowadzą do analogicznego wzoru na obniżenie temperatury krzepnięcia
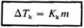
(4.30)
gdzie stała kriometryczna
(4.31)
RT\ Mx 1000 A//*
przy czym Tx jest temperaturą krzepnięcia czystego rozpuszczalnika, a A//k — ciepłem topnienia 1 moła czystego rozpuszczalnika.
W tabelach 4.1 i 4.2 zestawiono dane'fizykochemiczne dla niektórych najważniejszych rozpuszczalników stosowanych w ebuliometrii i kriometrii.
Tabela 4.1
Stale ebuliometrycznc niektórych rozpuszczalników
|
Rozpuszczalnik |
A//w(cal/mol) |
Tt |
/fw(deg- kg/mol) obliczone |
A\«(deg • kg/moł) doświadcz. |
|
Woda |
9720. |
373,16 |
0.514 |
0,51 |
|
Chloroform |
7020 |
334.4 |
3,78 |
3.77 |
|
Alkohol etylowy |
9220 |
351,7 |
1,227 |
1.20 |
|
Benzen |
7350 |
353.3 |
2.642 |
2,63 |
Jak widzimy zgodność pomiędzy obliczonymi na podstawie wzorów (4.24) i (4.31) a znalezionymi doświadczalnie wartościami i Kk jest na ogół bardzo dobra.
Pomiary ebuliometryczne, a zwłaszcza kriometryczne są szeroko stosowane w badaniach fizykochemicznych. Najbardziej ogólnym zastosowaniem jest
Wyszukiwarka
Podobne podstrony:
271 [1024x768] 280 ROZTWORY I RÓWNOWAGI FAZOWE jeżeli nie takie same, to w każdym razie bardzo podob
275 [1024x768] 284 ROZTWORY I RÓWNOWAGI FAZOWE czystego rozpuszczalnika i roztworu. Punkt krzepnięci
281 [1024x768] 290 ROZTWORY J RÓWNOWAGI FAZOWE W tym przypadku nie ma znaczenia, czy para nad roztwo
283 [1024x768] 292 ROZTWORY I RÓWNOWAGI FAZOWE (4.37) gdzie //(r„c„, — ciśnienie osmotyczne rzeczywi
285 [1024x768] 294 ROZTWORY 1 RÓWNOWAGI FAZOWE gdzie: L, — ciepło sublimacji, a Lm —ciepło parowania
293 [1024x768] 302 ROZTWORY I RÓWNOWAGI FAZOWEDestylacja Przeanalizujmy dokładniej prosty diagram wr
295 [1024x768] 304 ROZTWORY I RÓWNOWAGI FAZOWE mniej lub bardziej trwałych związków pomiędzy składni
297 [1024x768] 306 ROZTWORY I RÓWNOWAGI FAZOWE przeciwległego do wierzchołka odpowiadającego czystem
300 [1024x768] 308 ROZTWORY I RÓWNOWAGI FAZOWE podwójnych. Obszar H20aeb obejmuje nienasycone roztwo
302 [1024x768] 310 ROZTWORY I RÓWNOWAGI FAZOWE12• Obniżenie temp. krzepnięcia dla 0,1 m roztworu kwa
263 [1024x768] 272 ROZTWORY I RÓWNOWAGI FAZOWE Ścisła definicja fazy jest więc następująca: Fazą naz
265 [1024x768] 274 ROZTWORY 1 RÓWNOWAGI FAZOWE Ponieważ dG = Vdp — SdTyoydp-Si^dT - y^dp-S^dT (4.6)
267 [1024x768] 276 ROZTWORY 1 RÓWNOWAGI FAZOWE px jest tu szukanym ciśnieniem pary w temp. 33°C, nat
269 [1024x768] 278 ROZTWORY I RÓWNOWAGI FAZOWE wyżej temp. 374°C, tj. powyżej temperatury krytycznej
279 [1024x768] ROZTWORY I RÓWNOWAGI FAZOWE niż nad roztworem, wobec tego zachodzić będzie proces sta
287 [1024x768] ROZTWORY I RÓWNOWAGI FAZOWE %wag. fenolu *wag.
261 [1024x768] część czwarta roztwory i równowagi fazowe
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
więcej podobnych podstron