306 [1024x768]

316 ELEKTROCHEMIA
Przewodnictwo elektrolitów
Przewodnictwo W przeciwieństwie do metali (przewodniki 1 rodzaju), przewodnictwo elektro-elektrolitów litów (przewodniki II rodzaju) związane jest z ruchem jonów w polu elektrycznym, a więc z przenoszeniem masy. Dla uniknięcia rzeczywistego przenoszenia jonów oraz wydzielania się na elektrodach produktów elektrolizy, która prowadziłaby do zmiany stężenia roztworu i polaryzacji elektrod, pomiaru przewodnictwa elektrycznego roztworów elektrolitów dokonuje się za pomocą prądu zmiennego o częstości rzędu 1000 Hz.
Zgodnie z II prawem Ohma, opór R elektrolitu zawartego pomiędzy elektrodami jest proporcjonalny do odległości elektrod /, a odwrotnie proporcjonalny do ich przekroju A:
* = (5.D
gdzie q — oporność właściwa, wyrażona w om • cm.
Odwrotność oporności właściwej nosi nazwę przewodnictwa właściwego x, które jest przewodnictwem 1 cm3 roztworu.
1
x — — Q
(5.2)
Przewodnictwo
RÓWNOWAŻ
NIKOWE
Chemiczną miarą przewodnictwa jest przewodnictwo równoważnikowe A, które jest przewodnictwem roztworu o objętości V, zawartej pomiędzy elektrodami oddalonymi o 1 cm i zawierającej 1 £ramorównoważnik elektrolitu.
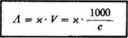
gdzie c — stężenie roztworu elektrolitu, wyrążone w val • dm-3.
Ponieważ przewodnictwo równoważnikowe każdego elektrolitu jest wynikiem ruchu takiej samej liczby anionów i kationów, zatem porównanie przewodnictw równoważnikowych różnych elektrolitów może dostarczyć informacji o stopniu dysocjacji elektrolitu, i prędkościach poruszania się jonów w polu elektrycznym.
Pierwszymi zależnościami, ustalonymi już przez Kohlrauscha w latach 1860—80, były zależności przewodnictwa równoważnikowego od stężenia. W tabeli 5.1 przedstawiono przewodnictwa równoważnikowe kilku elektrolitów w temp. 25°C przy różnych stężeniach.
Kohlrausch, na podstawie zmierzonych przewodnictw równoważnikowych przy różnych stężeniach, stwierdził, że wykreślając zależność przewodnictwa równoważnikowego od j/c (c — stężenie elektrolitu wyrażone
Wyszukiwarka
Podobne podstrony:
309 [1024x768] 318 ELEKTROCHEMIA do stężenia równego zeru, Kohlrausch wyznaczył tzw. przewodnictwa r
315 [1024x768] 324 ELEKTROCHEMIAElektroliza Do pomiaru przewodnictw elektrolitów stosuje się prąd zm
367 [1024x768] 376 ELEKTROCHEMIA (2) do roztworu (1), a więc w przeciwną stronę, przejdzie /- gramoj
IMAG0581 elektrony przewodnictwa Do złącza n-p przykładamy napięcie w
img264 24. Przeciwwskazania do elektroterapii przeciwbólowej to m in.: a)
297 [1024x768] 306 ROZTWORY I RÓWNOWAGI FAZOWE przeciwległego do wierzchołka odpowiadającego czystem
59692 skan0313 316 Elektrochemia Rys. 6.8. Polarografia: a) przykładany do KER potencjał, b) fala
424 [1024x768] POLARYZACJA ELEKTROLITYCZNA I NADNAPIĘCIE 433 Całkowita szybkość docierania jonów do
427 [1024x768] 436 ELEKTROCHEMIA w porównaniu do pierwszego (gdyż rj < 0); wtedy hF “* KT V i - i
434 [1024x768] BIOLOGICZNI. ASPEKTY POMIARÓW ELEKTROCHEMICZNYCH jest proporcjonalne do prężności C02
437 [1024x768] 446 ELEKTROCHEMIA tworu 1 do roztworu II t+ gramorównoważników jonu H+ oraz t~ gramor
438 [1024x768] BIOLOGICZNE ASPEKTY POMIARÓW ELEKTROCHEMICZNYCH selektywności w stosunku do anionu. D
P1120604 [1024x768] 151 Rys 2. Zależność przewodnictwa równoważnikowego elektrolitów od ich stężenia
I INNYMI Z ELEKTROMAGNESAMI, ALARMAMI PRZECIWWŁAMANIOWYMI GADŻETAMI DO ZŁOŻENIA W DOMU „SCIENCE
43 4 podobnie jak NAD+, może przyjmować dwa elektrony. Czyniąc to, FAD, w przeciwieństwie do NAD+, w
OM-(jednostka oporu elektrycznego). iri=lV/A [RJ. Najlepszym przewodnikiem elektrycznym jest srebro.
więcej podobnych podstron