385 [1024x768]

394
ELEKTROCHEMIA
Wyznaczanie współczynników aktywności metodą izopiestyczną
W poprzednich metodach pomiaru współczynników aktywności mierzyliśmy zawsze pewną właściwość substancji rozpuszczonej (np. przewodnictwo, rozpuszczalność, SEM ogniw, itp.). W badaniach tych rozpuszczalnik służył jedynie jako środowisko, w którym dokonywaliśmy pomiaru pewnej właściwości substancji rozpuszczonej. W roztworach jednakże bardziej stężonych (c > 0,1 M) pomiary współczynnika aktywności tymi metodami są bardzo utrudnione, a przy roztworach bardziej stężonych, praktycznie niemożliwe. W tych przypadkach musimy naszą uwagę zwrócić na rozpuszczalnik.
Aktywność rozpuszczalnika a, w roztworze o ułamku molowym rozpuszczalnika .Y|, można łatwo wyznaczyć z prawa Raoulta (4.18) dla roztworów rzeczywistych, według którego lotność rozpuszczalnika nad roztworem /, jest proporcjonalna do lotności rozpuszczalnika nad czystym rozpuszczalnikiem /?:
/, = «>, n
Jeżeli ciśnienia nie są zbyt wysokie (p < l atm), to możemy założyć, że faza gazowa zachowuje się jak gaz doskonały i w miejsce lotności stosować ciśnienia:
P\ =*\‘P\
gdzie: p, i p? oznaczają ciśnienie rozpuszczalnika nad roztworem i nad czystym rozpuszczalnikiem. W ten sposób mierząc prężność pary p rozpuszczalnika nad roztworem o ułamku molowym rozpuszczalnika xt możemy znaleźć jego aktywność:
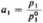
a znając aktywność i ułamek molowy, możemy wyznaczyć współczynnik aktywności rozpuszczalnika y,:
a,
y» - —
Analogiczne postępowanie moglibyśmy także zastosować do substancji rozpuszczonej — pod warunkiem jednakże, że substancja ta jest również lotna i że potrafimy dokładnie zmierzyć ciśnienia cząstkowe rozpuszczalnika i substancji rozpuszczonej.
W przypadku roztworów elektrolitów, substancja rozpuszczona jest na ogół nielotna, tak więc postępowania tego nic możemy zastosować do substancji rozpuszczonej a jedynie do rozpuszczalnika. Problem, który się tutaj
Wyszukiwarka
Podobne podstrony:
381 [1024x768] 390 ELEKTROCHEMIAMetody wyznaczania współczynników aktywności Wyznaczanie współczynni
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
327 [1024x768] 336 ELEKTROCHEMIA Jeżeli współczynniki aktywności kationu i anionu oznaczyć przez y+
439 [1024x768] 448 ELEKTROCHEMIA Średni współczynnik aktywności K2S04 w 0,01 molamym roztworze wodny
383 [1024x768] 3*2 ELEKTROCHEMIA Podobnie jak .przy wyznaczaniu współczynnika aktywności przez pomia
wymaganiar bmp 3. Roztwory rzeczywiste Rys. 3.24. Wyznaczenie współczynnika aktywności f2 z pomiarów
Rys. III/5. Wyznaczanie współczynnika tarcia metodą Pawłowa: a) schemat, b) układ sił działających n
Rys. III/8. Schemat wyznaczania współczynnika tarcia metodą spęczania próbki klinowej Należy zwrócić
4. Zalecenia 4.1. Przedstawienie wyników pomiarów Temat 1. Wyznaczanie współczynnika tarcia metodą
Obraz47 Doświadczalne wyznaczanie współczynnika filtracji - metoda Darcy’ego i I ś Mi Dane: A — poie
obw mag sprzez03 Wyznaczanie współczynnika sprzężenia metodą szeregowego łączenia
W pierwszej części ćwiczenia wyznaczaliśmy współczynnik lepkości metoda bezwzględną. Metoda ta opier
więcej podobnych podstron