wymaganiar bmp

3. Roztwory rzeczywiste
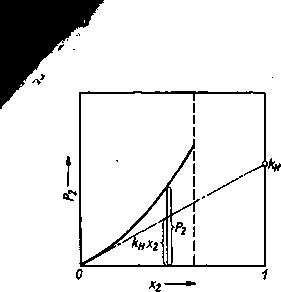
Rys. 3.24. Wyznaczenie współczynnika aktywności f2 z pomiarów prężności cząstkowej pary składnika 2 nad roztworem: fi = P/knTi
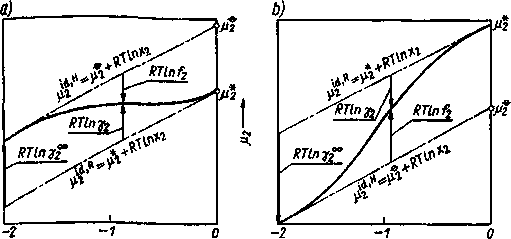
Zależność pomiędzy współczynnikami aktywności w symetrycznym i niesymetrycznym układzie odniesienia przedstawiono na rys. 3.25 otrzymanym w wyniku nałożenia na siebie rys. 3.23 oraz 3.4. Proste fi^'R oraz opisane odpowiednio wyrażeniami (2.35) oraz (3.11) reprezentują zależności potencjału chemicznego składnika 2 od jego ułamka molowego w roztworach doskonałych odpowiednio w sensie prawa Raoułta i prawa Henry’ego. Różnica potencjałów chemicznych p® - /ij określa graniczną wartość, do której dąży współczynnik aktywności 72, gdy ułamek molowy x2 dąży do zera - oznacza się ją 7.J0.
= exp (3-125) \
Rysunek 3.25 pokazuje, że niezależnie od znaku odchyleń od t prawa Raoułta, współczynniki aktywności wiąże relacja
RTI117J0 = RTln 72 - RT ln f2 (3.126)
którą można zapisać w postaci równoważnej
h =
(3.127)
72
-,00
72
3.8. Niesymetryczny układ odniesienia
111
lnX2-in X2-»-
Rys. 3.25. Interpretacja geometryczna współczynników aktywności w dwu układach odniesienia: a) dodatnie odchylenia od prawa Raoułta, b) odchylenia ujemne
Przykład 3.11. Porównanie współczynników aktywności w dwu układach odniesienia.
Na podstawie izotermicznych danych równowagowych układu ciecz-para obliczyć wartości współczynników aktywności w symetrycznym i niesymetrycznym układzie odniesienia składników roztworu: cykloheksan (1) - anilina (2).
Dane: Równowagowe dane1 badanego układu w temp. t — 50,2°C zestawiono w trzech pierwszych kolumnach tabl. 3.6. Podano sumaryczna prężność pary nasyconej P oraz skład fazy ciekłej x-> i gazowej j/2- Prężności par nasyconych czystych składników wynoszą odpowiednio: P* = 273, 0 Tr oraz Pj = 3,47 Tr.
Rozwiązanie: Z uwagi na dużą dysproporcję prężności par nasyconych czystych składników faza gazowa zawiera znaczną przewagę składnika bardziej lotnego więc wyznaczenie składu pary jest trudne doświadczalnie. Współczynniki aktywności w symetrycznym układzie odniesienia (72 i 71) autorzy cytowanej pracy obliczyli ze wzorów (3.30) z pominięciem niedoskonałości fazy gazowej - błąd wynikający z tego uproszczenia jest pomijalny w porównaniu z dokładnością pomiaru. Wyniki obliczeń zestawiono w czwartej i piątej
L.Abello i in.: Buli.Soc.Chim.France. 1968, 11,4360.
Wyszukiwarka
Podobne podstrony:
wymagania? bmp 3. Roztwory rzeczywiste Rys. 3.1. Zależność prężności cząstkowych składników P i Ą or
wymaganiai bmp 3. Roztwory rzeczywiste nazywaną aktywnością składnika j, którą trzeba wyznaczyć dośw
wymaganias bmp 3. Roztwory rzeczywiste 3. Roztwory rzeczywiste ablica 3.6. Prężność pary, skład i ws
wymaganiap bmp 3. Roztwory rzeczywiste Analiza przebiegu krzywych potwierdza jakościowo przewidywani
wymagania? bmp 3. Roztwory rzeczywiste zatem gdy P = x
383 [1024x768] 3*2 ELEKTROCHEMIA Podobnie jak .przy wyznaczaniu współczynnika aktywności przez pomia
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
35 (60) Zasady odczytu danych ze skali Bonjeana (rys. 24): • wyznaczyć zanurzenia
wymagania2 bmp warstw płynu (rys. 2.17). Przesuwanie takie wymaga pokonania oporu zwane-; go tarciem
wymaganiay bmp )2 2. Roztwory doskonale oraz P2 = 0. 5599 ■ 0,4400 = 0,2463 bar. Sumaryczna prężność
wymagania? bmp 2. Roztwory doskonale Po podstawieniu do wzoru (2.51) obliczamy P = 0,3618 • 0.8678 =
Rys. III/5. Wyznaczanie współczynnika tarcia metodą Pawłowa: a) schemat, b) układ sił działających n
Rys. 6.12. Wyznaczanie współczynnika konfiguracji powierzchni g? i,2 a) dla powier
więcej podobnych podstron